首页 > 拉那利尤单抗注射液说明书
修改日期:2020年12月2日
拉那利尤单抗注射液说明书(Catalent Indiana,LLC)
请仔细阅读说明书并在医师指导下使用
- 【药品名称】
- 通用名称: 拉那利尤单抗注射液
处方药物
【成份】
主要成份:拉那利尤单抗化学名称:Lanadelumab,拉那利尤单抗化学结构式:Lanadelumab 由两条轻链和两条重链组成,带有一个 N-糖基化位点。分子式:基于表达载体中的 DNA 序列翻译成的氨基酸序列。分子量:根据氨基酸序列,非糖基化 Lanadelumab,的分子量为 146716Da。完全还原后,轻链的分子量计算值为 23424Da。完全还原的非糖基化重链的分子量计算值为 49450Da。辅料:磷酸氢二钠二水合物、枸橼酸一水合物、L-组氨酸、氯化钠、聚山梨酯 80、注射用水
【适应症】
本品适用于 12 岁及以上患者预防遗传性血管性水肿(HAE)的发作。
【规格】
300 mg/2 mL(150 mg/mL)。
【用法用量】
推荐的起始剂量为 300 mg 每两周一次。300 mg 每 4 周一次也有效,如果患者病情得到充分控制(即,无发作)达到 6 个月以上,则可以考虑使用该给药间期。本品仅供皮下注射使用。本品为即用型溶液,装于单剂量小瓶内,给药时不需要额外的复溶或稀释。本品是一种澄清至略带乳白色、无色至微黄色溶液。如果溶液变色或者有可见颗粒,请勿使用本品。请勿剧烈摇动药瓶。本品可以自行注射,也可以由照料者进行注射。应由一名专业医护人员对患者或照料者进行注射培训。在注射前 15 分钟从冰箱中取出本品药瓶,使得药瓶恢复至室温。使用无菌技术,通过 18 G 针头从药瓶内抽取处方剂量的本品。然后,将注射器上的针头换成 27 G 针头、1/2-英寸针头或者其他适合进行皮下注射的针头。本品应皮下注射于腹部、大腿或上臂。患者应当注射医生处方的全剂量。在临床研究中,大多数患者自行注射本品,10 至 60 秒内注射完毕。本品应在准备好给药注射器后 2 小时内给予。在准备好给药注射器后,可以将注射器置于 2 ℃ 至 8 ℃ 的冰箱中冷藏,但必须在 8 小时内使用。丢弃药瓶和注射器中未使用的药物部分。有关本品制备和给药的信息详见后附说明。
本品制备和给药说明第 1 步:制备注射液· 收集所有用品并置于光线充足的平整工作台上。
· 在使用前 15 分钟将药瓶从冰箱中取出,并在制备注射液前静置使其达到室温。· 检查本品的包装盒和药瓶标签上的失效日期。如果已过期,则请勿使用。
· 检查用品是否有破损。如有破损,则请勿使用。· 在制备剂量之前,清洁您的工作区域并洗手。洗手后注射前,请勿触摸任何表面或身体部位,尤其是您的面部。· 从包装中取出药瓶。如缺少塑料盖帽,则请勿使用此药瓶。

第 2 步:将转移针头连接至注射器
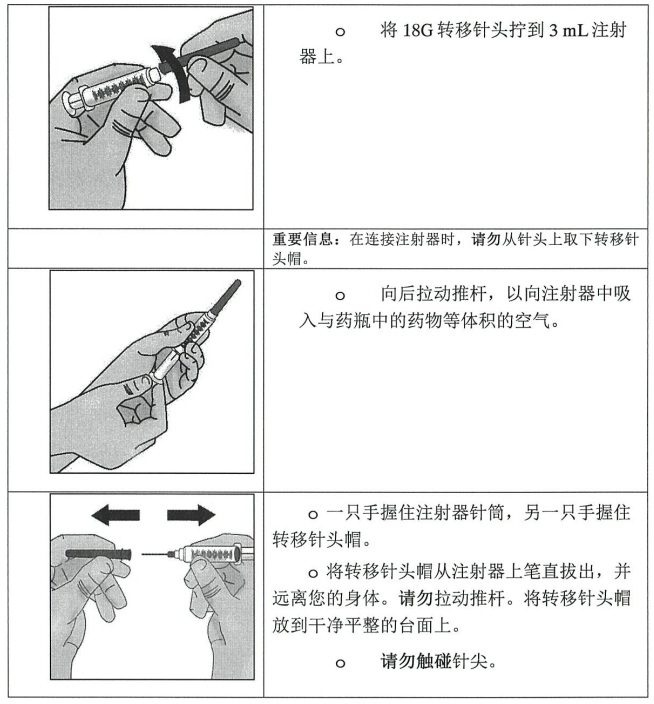
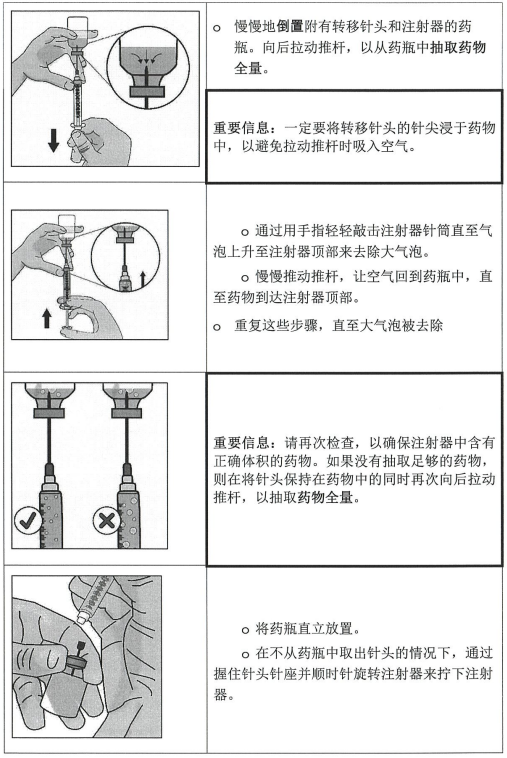
第 3 步:将本品转移至注射器中并换成注射针头


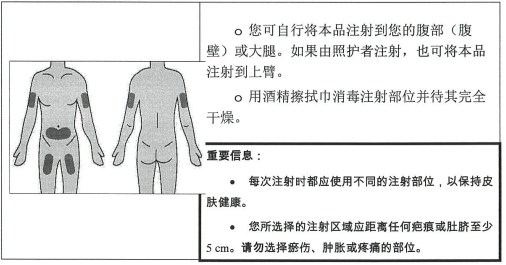
第 4 步:选择并准备注射部位

第 5 步:注射本品
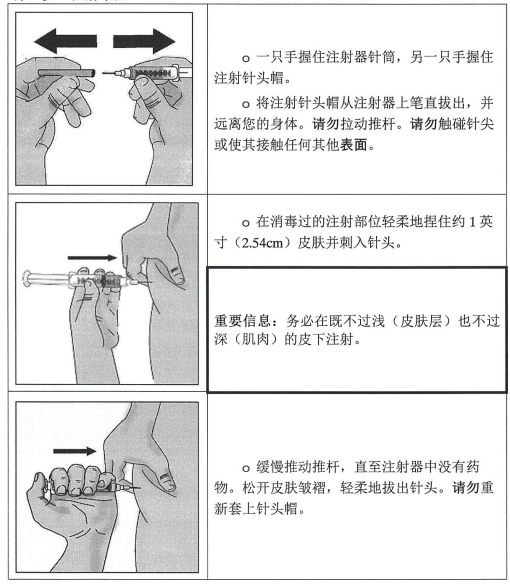
第 6 步:丢弃(处置)针头和注射器


【禁忌】
对本品中任何成份过敏的患者禁用。
【注意事项】
现已观察到超敏反应。如果发生重度超敏反应,请停用本品并且开始适当的治疗。
本品不适用于治疗急性 HAE 发作。
【临床药理】
血浆激肽释放酶将高分子量激肽原(HMWK)裂解为活化型高分子量激肽原(cHMWK)以及引起局部肿胀和疼痛症状的血管扩张物缓激肽。拉那利尤单抗可与血浆激肽释放酶结合,抑制其蛋白水解活性,减少患者体内缓激肽的过度生成。
【药理毒理】
生殖毒性性成熟食蟹猴 13 周皮下注射拉那利尤单抗 50 mg/kg/周,暴露量(基于 AUC)相当于人体最大推荐剂量(MRHD)时暴露量的 22 倍,生殖系统未见给药相关的组织病理学改变。妊娠食蟹猴从妊娠第 20 天至分娩,每周一次皮下注射拉那利尤单抗 50 mg/kg/周,母体暴露量(基于 AUC)相当于 MRHD 时暴露量 33 倍,未见对妊娠状态、胚胎存活、生长发育或子代发育(3 个月内)的毒性。拉那利尤单抗可透过猴胎盘。出生后第 21 天,拉那利尤单抗在食蟹猴子代体内的暴露量相当于母体动物血浆浓度的 50%;出生后第 90 天,在母体和子代血浆中浓度接近。拉那利尤单抗可通过乳汁分泌,乳汁中药物浓度约为血浆药物浓度的 0.2%。
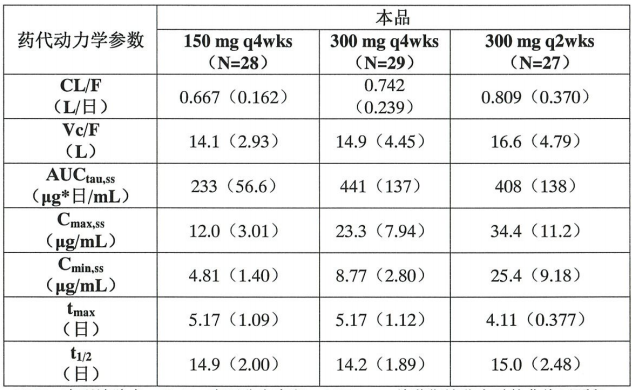
【药代动力学】
对 HAE 患者皮下注射本品后,本品在治疗剂量范围内的药代动力学大致与剂量成比例(表 2)。150 mg q4wks、300 mg q4wks 和 300 mg q2wks 皮下注射后,本品在 HAE 患者体内的药代动力学特征和暴露量(稳态)参见表 2。皮下注射本品后,在 5 天内达到血浆峰浓度,终末消除半衰期约为 2 周。预计浓度达稳态时间约为 70 天。浓度达稳态时,150 mg q4wks、300 mg q4wks 和 300 mg q2wks 给药方案的平均蓄积率分别约为 1.44、1.42 和 2.43。

特殊人群用药群体药代动力学分析显示,在按体重校正后,年龄、性别和人种没有明显影响本品的药代动力学。体重是描述清除率和分布容积变化的一个重要协变量,体重较轻患者的暴露量更高(AUC 和 Cmax)。但是,该差异不具有临床相关性,不需要进行剂量调整。儿童人群群体药代动力学(PK)分析显示,12 至 < 18 岁儿科患者每 2 周皮下注射一次本品 300 mg 后,平均(±SD)AUCss 为 629(204)μg*日/mL。在使用相同给药方案时,由于儿科患者的体重较轻,所以该值大约比成人患者的平均 AUCss(460 μg*日/mL)高 37%。
肾损害尚未开展专门研究来评价本品在肾损害患者体内的 PK。群体药代动力学分析显示,肾损害(GFR 估计值:60-89 mL/min/1.73m2,[轻度,N = 98]以及 30-59 mL/min/1.73m2,[中度,N = 9])对本品的清除率或分布容积无影响。
【生产企业】
企业名称:Catalent Indiana,LLC
【上市许可持有人】
Takeda Pharmaceuticals U.S.A., Inc.