艾基维仑赛(Abecma):详细说明书及处方信息
处方信息重点
这些重点并未包含安全有效地使用 ABECMA 所需的所有信息。请参阅 ABECMA 的完整处方信息。ABECMA
® ( idecabtagene vicleucel),静脉输注用混悬液
美国首次批准:2021 年
警告:细胞因子释放综合征、神经毒性、HLH/MAS、长期血细胞减少症和继发性血液系统恶性肿瘤
请参阅完整的处方信息以了解完整的黑框警告。
•接受 ABECMA 治疗的患者中发生了细胞因子释放综合征 (CRS),包括致命或危及生命的反应。请勿给有活动性感染或炎症性疾病的患者使用 ABECMA。使用托珠单抗或托珠单抗和皮质类固醇治疗严重或危及生命的 CRS(2.2、2.3、5.2、6.1)。
•接受 ABECMA 治疗后,包括 CRS 同时发生、CRS 消退后或无 CRS 时,可能会发生严重或危及生命的神经系统毒性。接受 ABECMA 治疗后,应监测神经系统事件。根据需要提供支持性护理和/或皮质类固醇(2.2、2.3、5.3)。
•接受 ABECMA 治疗的患者中发生了噬血细胞性淋巴组织细胞增生症/巨噬细胞活化综合征 (HLH/MAS),包括致命和危及生命的反应。HLH/MAS 可能与 CRS 或神经系统毒性同时发生(5.4)。
•在接受 ABECMA 治疗后,出现了伴随出血和感染的长期血细胞减少症,包括因造血恢复而进行干细胞移植后出现的致命后果 ( 5.8 )。
•在使用 BCMA 和 CD19 导向的基因改造自体 T 细胞免疫疗法(包括 ABECMA( 5.10))治疗血液系统恶性肿瘤后,发生了 T 细胞恶性肿瘤。
•ABECMA 仅可通过风险评和缓解策略 (REMS) 下名为 ABECMA REMS ( 5.5 )的受限计划获得。
近期重大变更
Abecma 的适应症和用法
ABECMA 是一种针对 B 细胞成熟抗原 (BCMA) 的转基因自体 T 细胞免疫疗法,用于治疗已接受过两种或两种以上疗法(包括免疫调节剂、蛋白酶体抑制剂和抗 CD38 单克隆抗体 ( 1 ))的复发或难治性多发性骨髓瘤成年患者。
Abecma 剂量和用法
仅供自体使用。仅供静脉内使用。
•在输注 ABECMA 之前,先进行环磷酰胺和氟达拉滨的淋巴细胞清除化疗方案 ( 2.2 )。
•输液前确认患者身份(2.2)。
•使用对乙酰氨基酚和 H1 抗组胺药进行预先用药( 2.2 )。
•避免预防性使用地塞米松或其他全身性皮质类固醇(2.2)。
•ABECMA 的剂量取决于嵌合抗原受体 (CAR) 阳性 T 细胞的数量 ( 2.1 )。
•建议剂量范围为 300 至 510 × 10 6 CAR 阳性 T 细胞(2.1)。
•在经认证的医疗机构 ( 2.2、5.2、5.3、5.4 ) 管理 ABECMA。
剂型和规格
•ABECMA 是一种用于静脉输注的细胞悬浮液(3)。
•单剂量 ABECMA 包含一个或多个输液袋中的 300 至 510 × 10 6 CAR 阳性 T 细胞细胞悬浮液 ( 3 )。
禁忌症
无 ( 4 )。
警告和注意事项
•超敏反应:输液期间监测超敏反应(5.6)。
•感染:监测患者是否出现感染的体征和症状;予以适当治疗(5.7)。
•长期血细胞减少症:患者在输注 ABECMA 后可能出现长期 3 级或更高级别的血细胞减少症。在输注 ABECMA 之前和之后监测血细胞计数(5.8)。
•低丙种球蛋白血症:监测并考虑免疫球蛋白替代疗法(5.9)。
•继发性恶性肿瘤:使用 BCMA 和 CD19 定向基因改造自体 T 细胞免疫疗法(包括 ABECMA)治疗血液系统恶性肿瘤后,可能出现 T 细胞恶性肿瘤。如果使用 ABECMA 治疗后出现继发性恶性肿瘤,请拨打 1-888-805-4555 ( 5.10 ) 联系百时美施贵宝。
•对驾驶和使用机器能力的影响:建议患者在服用 ABECMA 后至少八周内不要驾驶或操作重型或潜在危险的机器(5.11)。
不良反应/副作用
最常见的非实验室不良反应(发生率大于或等于 20%)包括发热、CRS、低丙种球蛋白血症、感染 – 病原体不明、肌肉骨骼疼痛、疲劳、发热性中性粒细胞减少症、低血压、心动过速、腹泻、恶心、头痛、发冷、上呼吸道感染、脑病、水肿、呼吸困难和病毒感染(6.1)。
最常见的 3 级或 4 级实验室不良反应(发生率大于或等于 50%)包括白细胞计数减少、中性粒细胞计数减少、淋巴细胞计数减少、血小板计数减少和血红蛋白减少(6.1)。
如需报告疑似不良反应,请联系百时美施贵宝公司电话 1-800-721-5072 或 FDA 电话 1-800-FDA-1088 或访问 www.fda.gov/medwatch。
请参阅第 17 页了解患者咨询信息和用药指南。
修订日期:7/2024
完整处方信息
警告:细胞因子释放综合征、神经毒性、HLH/MAS、长期血细胞减少症和继发性血液系统恶性肿瘤
•接受 ABECMA 治疗的患者中发生了细胞因子释放综合征 (CRS),包括致命或危及生命的反应。请勿给有活动性感染或炎症性疾病的患者使用 ABECMA。使用托珠单抗或托珠单抗和皮质类固醇治疗严重或危及生命的 CRS [见剂量和给药 (2.2、2.3 ) 、警告和注意事项 (5.2)和不良反应 (6.1) ]。
•接受 ABECMA 治疗后,包括 CRS 同时发生、CRS 消退后或未出现 CRS 时,可能会发生严重或危及生命的神经毒性。接受 ABECMA 治疗后,应监测神经系统事件。根据需要提供支持性护理和/或皮质类固醇[见用法用量(2.2、2.3)和警告和注意事项(5.3) ]。
•接受 ABECMA 治疗的患者中发生了噬血细胞性淋巴组织细胞增生症/巨噬细胞活化综合征 (HLH/MAS),包括致命和危及生命的反应。HLH/MAS 可能与 CRS 或神经毒性同时发生[见警告和注意事项 (5.4) ]。
•接受 ABECMA 治疗后,出现了伴随出血和感染的长期血细胞减少症,包括因造血恢复而进行干细胞移植后出现的致命后果[见警告和注意事项(5.8) ]。
•在使用 BCMA 和 CD19 导向的转基因自体 T 细胞免疫疗法(包括 ABECMA)治疗血液系统恶性肿瘤后,出现了 T 细胞恶性肿瘤[见警告和注意事项(5.10) ]。
•ABECMA 仅可通过风险评估和缓解策略 (REMS) 下名为 ABECMA REMS 的受限计划获得[见警告和注意事项 (5.5) ]。
1. Abecma 的适应症和用法
ABECMA 是一种针对 B 细胞成熟抗原 (BCMA) 的转基因自体 T 细胞免疫疗法,用于治疗已接受过两种或两种以上疗法(包括免疫调节剂、蛋白酶体抑制剂和抗 CD38 单克隆抗体)的复发或难治性多发性骨髓瘤成年患者。
2. Abecma 剂量和用法
仅供自体使用。仅供静脉内使用。
2.1 剂量
ABECMA 以单剂量输注形式提供,包含一个或多个输注袋中的嵌合抗原受体 (CAR) 阳性 T 细胞悬浮液。建议剂量范围为 300 至 510 × 10 6 个CAR 阳性 T 细胞。
有关剂量的更多信息,请参阅随附的输液证书发布(RFI 证书)[请参阅如何供应/储存和处理(16) ]。
2.2 管理
ABECMA 仅供自体使用。患者身份必须与 ABECMA 盒和输液袋上的患者标识相符。如果患者专用标签上的信息与目标患者不符,请勿输注 ABECMA。
为患者准备 ABECMA 输注
在开始淋巴细胞清除化疗方案之前确认 ABECMA 是否可用。
预处理
给予淋巴细胞清除化疗方案:环磷酰胺 300 mg/m 2静脉注射 (IV) 和氟达拉滨 30 mg/m 2 IV 持续三天。
有关肾功能不全时剂量调整的信息,请参阅环磷酰胺和氟达拉滨的处方信息。
完成淋巴细胞清除化疗两天后给予 ABECMA。
如果患者有以下任何一种情况,则应延迟 ABECMA 的输注最多七天:
•未解决的严重不良事件(尤其是肺部事件、心脏事件或低血压),包括先前化疗后的不良事件。
•活动性感染或炎症性疾病[见警告和注意事项(5.7) ]。
术前用药
在输注 ABECMA 前约 30 至 60 分钟给予对乙酰氨基酚(口服 650 毫克)和苯海拉明(静脉注射 12.5 毫克或口服 25 至 50 毫克,或另一种 H 1抗组胺药)。
避免预防性使用地塞米松或其他全身性皮质类固醇,因为使用可能会干扰 ABECMA 的活性。
收到 ABECMA
•ABECMA 通过液氮运输箱的气相直接运送至输液中心相关的细胞实验室或临床药房。
•通过托运人上的患者识别符确认患者的身份。
•如果预计患者在运输期限到期前无法准备好当天给药,且输注部位符合现场储存条件,则将 ABECMA 转移到液氮储存的现场气相中。
•如果预计患者在运输包装到期之前无法进行当天给药,且输注部位不符合现场储存条件,请拨打 1-888-805-4555 联系百时美施贵宝公司安排退货运输。
输注用 ABECMA 的制备
1.协调 ABECMA 解冻和输注的时间。提前确认输注时间,调整 ABECMA 解冻的开始时间,以便在患者准备好时可以进行输注。
2.解冻产品前,请确认在输注前和恢复期间托珠单抗和急救设备已准备就绪。
3.一剂 ABECMA 可能包含在一个或多个患者专用输液袋中。在准备 ABECMA 输液前,请核实收到的 ABECMA 指示剂量的输液袋数量。
4.确认患者身份:在准备 ABECMA 之前,将患者的身份与 ABECMA 盒、输液袋和 RFI 证书上的患者标识符进行匹配。
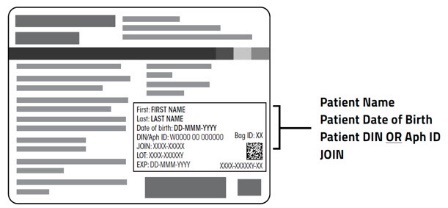
注意:患者识别号前面可能带有字母 DIN 或 Aph ID。
5.如果患者专用盒标签上的信息与目标患者不匹配,请勿从盒中取出 ABECMA 输液袋。如果标签和患者标识符之间存在任何差异,请拨打 1-888-805-4555 联系 Bristol-Myers Squibb。
6.确认患者身份后,从盒中取出 ABECMA 输液袋,并检查盒标签上的患者信息是否与袋子标签上的患者信息相符。
图 1:ABECMA 袋子标签 |
|
|
7.解冻前,检查输液袋是否有破损或裂缝等容器完整性问题。如果输液袋破损,请勿输液,并致电 1-888-805-4555 联系 Bristol-Myers Squibb。
8.如果为了达到治疗剂量使用了多个输液袋,则每次解冻一个输液袋。在前一个输液袋输液完成之前,不要开始解冻下一个输液袋。
9.按照当地的指导方针将输液袋放入第二个无菌袋内。
10.使用经批准的解冻设备或水浴在约 37°C 的温度下解冻 ABECMA 输液袋,直至输液袋中没有可见的冰块。轻轻混合袋中的内容物,以分散可见的细胞物质团块。尽管手动轻轻混合,但仍可能存在小块细胞物质。输液前请勿清洗、旋转和/或在新培养基中重新悬浮 ABECMA。
11.ABECMA 应在解冻过程开始后一小时内给药。解冻后,ABECMA 在室温下可稳定保存两小时。
ABECMA 管理部门
•仅供自体使用。
•切勿使用白细胞去除过滤器。
•确保在输注前和恢复期间至少有两剂托珠单抗和急救设备可用。
•可以利用中心静脉通路输注 ABECMA,并鼓励外周通路较差的患者使用。
1.确认患者的身份与 ABECMA 输液袋上的患者标识符相符。
2.输液前用生理盐水灌注输液器管路。带有在线过滤器(孔径范围为 170 至 260 µm 的非白细胞去除过滤器)的输液器可用于解冻产品,这些产品含有可见的细胞物质团块,在轻轻手动混合后不会分散。
3.在重力流解冻开始后一小时内注入 ABECMA 输液袋的全部内容物。
4.输液袋中的所有内容物都输完后,用 30 至 60 mL 的生理盐水以相同的输液速率冲洗管道(包括在线过滤器(如果使用)),以确保尽可能多的细胞输入患者体内。
5.如果收到多个输液袋,请按指示对所有输液袋进行输液,每个输液袋执行 1-4 步。在前一个输液袋输液完成之前,不要开始解冻下一个输液袋。
ABECMA 含有人类血细胞,这些血细胞经过基因改造,携带有复制缺陷、自我灭活的慢病毒载体。处理和处置 ABECMA 时,请遵循通用预防措施和当地生物安全指南,以避免潜在的传染病传播。
监控
•在 REMS 认证的医疗机构管理 ABECMA。
•在认证的医疗机构接受 ABECMA 输注后,每天至少监测患者七天,观察其是否出现 CRS 和神经系统毒性的体征和症状[见警告和注意事项 ( 5.2、5.3 ) ]。
•
指导患者在输液后至少四周内留在认证医疗机构附近。
•指导患者输液后至少八周内不要驾驶或从事危险活动。
2.3 严重不良反应的处理
细胞因子释放综合征 (CRS)
根据临床表现识别 CRS [见警告和注意事项 (5.2) ]。评估并治疗发烧、缺氧和低血压的其他原因。
如果怀疑是 CRS,请按照表 1 中的建议进行处理。
应密切监测患有 CRS 的患者的心脏和器官功能,直至症状消退。对于患有 CRS 的患者,可考虑使用左乙拉西坦进行抗癫痫预防。
出现 2 级或更高级别 CRS(例如,对补液没有反应的低血压,或需要补充氧气的缺氧)的患者应接受连续心脏遥测和脉搏血氧饱和度监测。
对于严重或危及生命的 CRS,请考虑重症监护病房级别监测和支持疗法。
对于对托珠单抗或托珠单抗和皮质类固醇等一线干预措施有抵抗力的 CRS,请考虑替代治疗方案(即增加皮质类固醇剂量、替代抗细胞因子药物、抗 T 细胞疗法)。抵抗力 CRS 的特征是发烧、终末器官毒性(例如缺氧、低血压)在一线干预措施后 12 小时内没有改善或出现噬血细胞性淋巴组织细胞增生症/巨噬细胞活化综合征 (HLH/MAS)。
如果怀疑 CRS 期间出现并发神经毒性,则应:
•根据表 1 和表 2 中的 CRS 和神经毒性等级,按照更积极的干预措施使用皮质类固醇
•托珠单抗按 CRS 等级见表 1
•根据表 2 中的神经毒性选择抗癫痫药物
表 1:CRS 评级和管理指南 |
||
|---|---|---|
CRS 等级a |
托珠单抗 |
皮质类固醇b |
a Lee的CRS 分级标准 (Lee 等人,2014)。b如果开始使用皮质类固醇, |
||
1 级 |
如果输注后 72 小时或更长时间发病,则对症治疗。 如果输注后发病时间少于 72 小时,考虑在 1 小时内静脉注射托珠单抗 8 mg/kg(不超过 800 mg)。 |
考虑每 24 小时静脉注射 10 毫克地塞米松。 |
2 级 氧气需求量低于 40% FiO 2或对液体有反应的低血压,或一种血管加压素的剂量低,或 2 级器官毒性。 |
以 8 mg/kg 的剂量静脉注射托珠单抗,持续 1 小时(不得超过 800 mg)。 24 小时内最多服用 3 剂;总共最多服用 4 剂。 |
考虑每 12-24 小时静脉注射 10 毫克地塞米松。 |
如果 24 小时内没有改善或进展迅速,则重复使用托珠单抗并增加地塞米松的剂量和频率(每 6 至 12 小时静脉注射 20 毫克)。 如果 24 小时内没有改善或继续快速进展,则改用甲基强的松龙 2 mg/kg,然后每天 4 次,每次 2 mg/kg。 服用 2 剂托珠单抗后,考虑使用其他抗细胞因子药物。24 |
||
3 级 发烧、需氧量大于或等于 40% FiO2 、或需要大剂量或多种血管加压药的低血压、或 3 级器官毒性或 4 级转氨酶升高。 |
每年级 |
每 12 小时静脉注射 10 毫克地塞米松。 |
如果 24 小时内无改善或进展迅速,则重复使用托珠单抗并增加地塞米松的剂量和频率(每 6 至 12 小时静脉注射 20 毫克)。 服用 2 剂托珠单抗后,考虑使用其他抗细胞因子药物。 24 小时内服用托珠单抗的剂量不得超过 3 剂,或总共服用不超过 4 剂。 |
||
4 级 |
每年级 |
每 6 小时静脉注射 20 毫克地塞米松。 |
服用 2 剂托珠单抗后,考虑使用其他抗细胞因子药物。24 小时内服用托珠单抗的剂量不得超过 3 剂,或总共服用 4 剂。 如果 24 小时内没有改善,请考虑使用甲基强的松龙(1-2 克,如有需要每 24 小时重复一次;根据临床指征逐渐减少剂量)或其他抗 T 细胞疗法。 |
||
神经毒性
监测患者是否出现神经毒性的体征和症状(表 2)。排除引起神经系统体征或症状的其他原因。对严重或危及生命的神经系统毒性提供重症监护支持治疗。如果怀疑有神经系统毒性,请按照表 2 中的建议进行处理。
如果在神经毒性事件期间怀疑出现并发 CRS,则应:
•根据表 1 和表 2 中的 CRS 和神经毒性等级,按照更积极的干预措施使用皮质类固醇
•托珠单抗按 CRS 等级见表 1
•表 2 中根据神经毒性划分的抗癫痫药物
表 2:神经毒性分级及处理指南 |
|
|---|---|
神经毒性a级 |
皮质类固醇和抗癫痫药物 |
a NCI CTCAE 神经毒性分级标准 4.03 版。 |
|
1 年级 |
开始使用非镇静抗癫痫药物(例如左乙拉西坦)预防癫痫发作。 |
2 年级 |
开始使用非镇静性抗癫痫药物(例如左乙拉西坦)预防癫痫发作。 |
3 年级 |
开始使用非镇静性抗癫痫药物(例如左乙拉西坦)预防癫痫发作。 |
4 年级 |
开始使用非镇静抗癫痫药物(例如左乙拉西坦)预防癫痫发作。 |
3. 剂型和规格
ABECMA 是一种用于静脉输注的细胞悬浮液。
单剂量 ABECMA 包含一个或多个输液袋中的300 至 510 × 10 6嵌合抗原受体 (CAR) 阳性 T 细胞的细胞悬浮液[请参阅如何供应/储存和处理 (16) ]。
4.禁忌症
没有任何。
5. 警告和注意事项
5.1 早逝
在 KarMMa-3 这项随机 (2:1) 对照试验中,ABECMA 组在随机分组后 9 个月内死亡的患者比例 (45/254; 18%) 高于标准方案组 (15/132; 11%) [见临床研究 (14) ]。在 ABECMA 输注和标准方案给药前,早期死亡率分别为 8% (20/254) 和 0%,在 ABECMA 输注和标准方案给药后,早期死亡率分别为 10% (25/254) 和 11% (15/132)。在 ABECMA 输注前发生的 20 例死亡中,15 例死于疾病进展,3 例死于不良事件,2 例死于不明原因。在 ABECMA 输注后发生的 25 例死亡中,10 例死于疾病进展,11 例死于不良事件,4 例死于不明原因。
5.2 细胞因子释放综合征(CRS)
接受 ABECMA 治疗后,出现了 CRS,包括致命或危及生命的反应。在 KarMMa 和 KarMMa-3 研究 (N=349) 中,接受 ABECMA 治疗复发或难治性多发性骨髓瘤的患者中,89% (310/349) 出现了 CRS,其中 7% (23/349) 的患者出现 ≥ 3 级 CRS(Lee 分级系统),0.9% (3/349) 的患者出现 5 级 CRS。任何级别的 CRS 的中位发病时间为 1 天(范围:1 至 27 天),CRS 的中位持续时间为 5 天(范围:1 至 63 天)。在汇总研究中,接受 460 至 510 x 10 6 CAR 阳性 T 细胞剂量范围治疗的患者中,≥ 3 级 CRS 的发生率为 10% (7/71),而接受 300 至 460 x 10 6 CAR 阳性 T 细胞剂量范围治疗的患者中,≥ 3 级 CRS的发生率为 5.4% (13/241) 。
CRS 最常见的表现(大于或等于 10%)包括发热(87%)、低血压(30%)、心动过速(26%)、寒战(19%)和缺氧(16%)。可能与 CRS 相关的 3 级或更高级别事件包括低血压、缺氧、高胆红素血症、低纤维蛋白原血症、ARDS、心房颤动、肝细胞损伤、代谢性酸中毒、肺水肿、凝血病、肾衰竭、多器官功能障碍综合征和噬血细胞性淋巴组织细胞增生症/巨噬细胞活化综合征(HLH/MAS)[见不良反应(6.1) ]。
根据临床表现确定 CRS。评估并治疗引起发烧、缺氧和低血压的其他原因。据报道,CRS 与 HLH/MAS 的表现有关,并且这些综合征的生理学可能重叠。HLH/MAS 是一种可能危及生命的疾病。对于尽管接受治疗但仍出现 CRS 症状进展或 CRS 顽固性的患者,评估 HLH/MAS 的证据。请参阅第 5.4 节;噬血细胞性淋巴组织细胞增生症/巨噬细胞活化综合征。
在临床试验中接受 ABECMA 治疗的 349 名患者中,226 名 (65%) 患者接受了托珠单抗治疗;39% (135/349) 接受了单剂量治疗,而 26% (91/349) 接受了超过 1 剂托珠单抗治疗。总体而言,24% (82/349) 的患者接受了至少 1 剂皮质类固醇治疗以治疗 CRS。几乎所有接受皮质类固醇治疗 CRS 的患者也接受了托珠单抗治疗。对于接受 460 至 510 x 10 6 CAR 阳性 T 细胞剂量范围治疗的患者,76% (54/71) 的患者接受了托珠单抗治疗,35% (25/71) 的患者接受了至少 1 剂皮质类固醇治疗以治疗 CRS。对于接受 300 至 460 x 10 6 CAR 阳性 T 细胞剂量范围治疗的患者,63% (152/241) 的患者接受了托珠单抗治疗,20% (49/241) 的患者接受了至少 1 剂皮质类固醇治疗 CRS。
确保在输注 ABECMA 之前至少有两剂托珠单抗可用。
在 REMS 认证的医疗机构接受 ABECMA 输注后,至少每天监测患者七天,以观察其是否出现 CRS 的体征和症状。输注后至少四周内监测患者是否出现 CRS 的体征或症状。一旦出现 CRS 的体征,应立即开始支持治疗、托珠单抗和/或皮质类固醇治疗(见剂量和给药(2.3))。
建议患者一旦出现 CRS 的体征或症状,应立即就医[见患者咨询信息(17) ]。
5.3 神经毒性
神经系统毒性,包括免疫效应细胞相关神经毒性 (ICANS),可能很严重甚至危及生命,可能与 CRS 同时发生、在 CRS 消退后发生,或在使用 ABECMA 治疗后没有出现 CRS 的情况下发生。
在 KarMMa 和 KarMMa-3 研究中接受 ABECMA 治疗的患者中,40% (139/349) 发生了 CAR T 细胞相关神经毒性,其中 4% (14/349) 的患者为 3 级,0.6% (2/349) 的患者为 4 级。神经毒性发作的中位时间为 2 天(范围:1 至 148 天)。所有患者(包括在死亡或数据截断时有持续神经系统事件的患者)的 CAR T 细胞相关神经毒性持续时间的中位时间为 8 天(范围:1 至 720 天)。139 名 (88%) 患者中的 123 名 CAR T 细胞相关神经毒性得到缓解,缓解的中位时间为 5 天(范围:1 至 245 天)。349 名 (38%) 出现神经毒性的患者中,134 名出现 CRS。 93 名患者在 CRS 期间出现神经毒性,12 名患者在 CRS 发生前出现神经毒性,29 名患者在 CRS 事件发生后出现神经毒性。接受 460 至 510 x 10 6 个 CAR 阳性 T 细胞和 300 至 460 x 10 6 个CAR 阳性 T 细胞治疗的患者中,3 级或4级 CAR T 细胞相关神经毒性发生率分别为 5.6% (4/71) 和 3.7% (9/241)。CAR T 细胞相关神经毒性最常见(大于或等于 5%)的表现包括脑病 (21%)、头痛 (15%)、头晕 (8%)、谵妄 (6%) 和震颤 (6%)。
在 KarMMa-3 研究的安全更新中,一名患者在接受 ABECMA 治疗 43 天后出现致命的神经毒性。在 KarMMa 中,一名患者在死亡时持续出现 2 级神经毒性。在数据截止时,两名患者持续出现 1 级震颤。
在另一项针对多发性骨髓瘤的研究中,一名患者使用 ABECMA 后出现了脑水肿。在另一项针对多发性骨髓瘤的研究中,患者在使用 ABECMA 治疗后出现了 3 级脊髓炎和 3 级帕金森病。
在 REMS 认证的医疗机构接受 ABECMA 输注后,至少每天监测患者七天,以观察其神经毒性的体征和症状。排除引起神经症状的其他原因。输注后至少四周内监测患者是否出现神经毒性的体征或症状,并及时治疗。应根据需要采用支持性治疗和/或皮质类固醇治疗神经毒性[见用法用量 (2.3) ]。
建议患者一旦出现神经毒性的体征或症状,应立即就医[见患者咨询信息(17) ]。
5.4 噬血细胞性淋巴组织细胞增生症 (HLH)/巨噬细胞活化综合征 (MAS)
在 KarMMa 和 KarMMa-3 研究中接受 ABECMA 治疗的患者中,HLH/MAS 发生率为 2.9% (10/349)。所有 HLH/MAS 事件均在接受 ABECMA 治疗后 10 天内发生,中位发病时间为 6.5 天(范围:4 至 10 天),且发生在 CRS 持续或恶化的背景下。5 名 HLH/MAS 患者有重叠的神经毒性。HLH/MAS 的表现包括低血压、缺氧、多器官功能障碍、肾功能障碍和血细胞减少。
在 KarMMa-3 中,一名患者为 5 级,两名患者为 4 级,两名患者为 3 级 HLH/MAS。患有 5 级 HLH/MAS 的患者还患有 5 级念珠菌败血症和 5 级 CRS。在另一名因中风死亡的患者中,4 级 HLH/MAS 在死亡前已缓解。两例 3 级 HLH/MAS 和一例 4 级 HLH/MAS 已缓解。
在 KarMMa 中,一名接受 300 x 10 6 CAR 阳性 T 细胞剂量组治疗的患者出现了致命的多器官 HLH/MAS 和 CRS。在另一名患有致命支气管肺曲霉病的患者中,HLH/MAS 是导致死亡的一个因素。三例 2 级 HLH/MAS 病例得到解决。
HLH/MAS 是一种可能危及生命的疾病,如果不及早发现并治疗,死亡率很高。HLH/MAS 的治疗应按照机构标准进行。
5.5 ABECMA 远程管理
由于存在 CRS 和神经毒性的风险,ABECMA 仅通过风险评估和缓解策略 (REMS) 下名为 ABECMA REMS 的限制计划提供[见黑框警告和警告和注意事项 ( 5.2、5.3 ) ]。
ABECMA REMS 所需的组件包括:
•分发和管理 ABECMA 的医疗机构必须注册并遵守 REMS 要求。
•经认证的医疗机构必须能够在现场立即获取托珠单抗。
•确保每位患者在 ABECMA 输注后两小时内至少有两剂量的托珠单抗可供输注,以备治疗 CRS 之用。
•更多信息请访问 www.AbecmaREMS.com 或联系百时美施贵宝,电话 1-866-340-7332。
5.6 超敏反应
输注 ABECMA 可能会引起过敏反应。严重的超敏反应(包括过敏反应)可能是由于 ABECMA 中的二甲基亚砜 (DMSO) 引起的。
5.7 感染
ABECMA 不应用于患有活动性感染或炎症性疾病的患者。患者在输注 ABECMA 后发生了严重、危及生命或致命的感染。
在 KarMMa 和 KarMMa-3 中接受 ABECMA 治疗的所有患者中,61% 的患者发生了感染(所有等级)。21% 的患者发生了 3 级或 4 级感染。12% 的患者发生了未指明病原体的 3 级或 4 级感染,7% 的患者发生了病毒感染,4.3% 的患者发生了细菌感染,1.4% 的患者发生了真菌感染。总体而言,15 名患者患有 5 级感染(4.3%);8 名患者(2.3%)感染了未指明病原体的感染,3 名患者(0.9%)感染了真菌感染,3 名患者(0.9%)感染了病毒,1 名患者(0.3%)感染了细菌感染。
在 ABECMA 输注前后监测患者的感染体征和症状并进行适当治疗。根据标准机构指南使用预防性、先发性和/或治疗性抗菌药物。
38% (133/349) 的患者在输注 ABECMA 后出现发热性中性粒细胞减少症,并且可能与 CRS 同时发生。如果出现发热性中性粒细胞减少症,请评估感染情况,并根据医学指征使用广谱抗生素、液体和其他支持性治疗进行治疗。
病毒再激活
服用 ABECMA 后,发生导致肺炎和死亡的巨细胞病毒 (CMV) 感染。根据临床指南监测和治疗 CMV 复发。
接受针对浆细胞的药物治疗的患者可能会发生乙型肝炎病毒 (HBV) 再激活,在某些情况下会导致暴发性肝炎、肝功能衰竭和死亡。
在收集细胞进行制造之前,按照临床指南对 CMV、HBV、丙型肝炎病毒 (HCV) 和人类免疫缺陷病毒 (HIV) 进行筛查。
根据当地机构指南/临床实践,考虑采取抗病毒疗法以防止病毒复发。
5.8 长期血细胞减少症
淋巴细胞清除化疗和 ABECMA 输注后,患者可能会出现长期血细胞减少症。
在 KarMMa 和 KarMMa-3 研究中接受 ABECMA 治疗的患者中,40% 的患者 (139/349) 经历了长时间的 3 级或 4 级中性粒细胞减少症,42% (145/349) 经历了长时间的 3 级或 4 级血小板减少症,且在 ABECMA 输注后 1 个月内尚未缓解。在 89% (123/139) 的患者中,1 个月后从 3 级或 4 级中性粒细胞减少症中恢复的患者中,从 ABECMA 输注中恢复的中位时间为 1.9 个月。在 76% (110/145) 的患者中,从 3 级或 4 级血小板减少症中恢复的患者中,中位恢复时间为 1.9 个月。五名患者因长时间血细胞减少症而接受干细胞疗法进行造血重建。在接受 460 至 510 x 10 6 CAR 阳性 T 细胞和 300 至 460 x 10 6 CAR 阳性 T 细胞剂量范围治疗的患者中,3 级或 4 级血小板减少症的发生率分别为 62% (44/71) 和 56 % (135/241) 。
监测 ABECMA 输注前后的血细胞计数。根据当地机构指南,使用髓系生长因子和血液制品输血支持治疗血细胞减少症。
5.9 低丙种球蛋白血症
接受 ABECMA 治疗的患者可能会出现浆细胞发育不全和低丙种球蛋白血症。
在 KarMMa 和 KarMMa-3 研究中,所有接受 ABECMA 治疗的患者中,13% (46/349) 的患者报告出现低丙种球蛋白血症不良事件;37% (130/349) 接受 ABECMA 治疗的患者在输注后实验室 IgG 水平降至 500 mg/dL 以下。
接受 ABECMA 治疗的患者中,45% (158/349) 的患者在输注后出现低丙种球蛋白血症(不良反应)或实验室 IgG 水平低于 500 mg/dL。41% 的患者在接受 ABECMA 治疗后接受静脉注射免疫球蛋白 (IVIG),因为血清 IgG <400 mg/dL。
监测 ABECMA 治疗后的免疫球蛋白水平,并在 IgG <400 mg/dL 时给予 IVIG。按照当地机构指南进行管理,包括感染预防措施和抗生素或抗病毒预防。
活疫苗的使用
尚未研究在 ABECMA 治疗期间或之后接种活病毒疫苗的安全性。在开始淋巴细胞清除化疗前至少六周、ABECMA 治疗期间以及 ABECMA 治疗后免疫恢复之前,不建议接种活病毒疫苗。
5.10 继发性恶性肿瘤
接受 ABECMA 治疗的患者可能会出现继发性恶性肿瘤。在 KarMMa-3 中,接受 ABECMA 治疗的患者中 2.2% (5/222) 出现髓系肿瘤(4 例骨髓增生异常综合征和 1 例急性髓系白血病),而安全更新时标准方案组无一例出现。从 ABECMA 输注到出现髓系肿瘤的中位时间为 338 天(范围:277 至 794 天)。这五名患者中有三名在出现髓系肿瘤后死亡。五例髓系肿瘤中有一例发生在开始后续抗骨髓瘤治疗后。
使用 BCMA 和 CD19 定向基因改造自体 T 细胞免疫疗法(包括 ABECMA)治疗血液系统恶性肿瘤后,曾发生过 T 细胞恶性肿瘤。成熟 T 细胞恶性肿瘤(包括 CAR 阳性肿瘤)可能在输注后数周内出现,并可能导致死亡[参见黑框警告、不良反应 (6.3)、患者咨询信息 (17) ]。
终生监测继发性恶性肿瘤。如果发生继发性恶性肿瘤,请拨打
1-888-805-4555 联系 Bristol-Myers Squibb 进行报告,并获取有关收集患者样本进行继发性恶性肿瘤检测的说明。
5.11 对驾驶和使用机器能力的影响
由于可能出现神经系统事件(包括精神状态改变或癫痫发作),接受 ABECMA 治疗的患者在输注 ABECMA 后的八周内,存在意识或协调能力改变或下降的风险。建议患者在此初始阶段不要驾驶和从事危险职业或活动,例如操作重型或潜在危险的机械。
6. 不良反应/副作用
标签其他部分描述了以下不良反应:
•早期死亡[见警告和注意事项(5.1),临床研究(14) ]
•细胞因子释放综合征[见警告和注意事项(5.2) ]
•神经系统毒性[见警告和注意事项(5.3) ]
•噬血细胞性淋巴组织细胞增生症 (HLH)/巨噬细胞活化综合征 (MAS) [见警告和注意事项 (5.4) ]
•超敏反应[见警告和注意事项(5.6) ]
•感染[见警告和注意事项(5.7) ]
•长期血细胞减少症[见警告和注意事项(5.8) ]
•低丙种球蛋白血症[见警告和注意事项(5.9) ]
6.1 临床试验经验
由于临床试验是在千差万别的条件下进行的,一种药物的临床试验中观察到的不良反应发生率不能直接与另一种药物的临床试验中的发生率进行比较,也可能无法反映临床实践中观察到的发生率。
“警告和注意事项”部分中描述的安全性数据反映了 349 名复发或难治性多发性骨髓瘤患者接受 ABECMA 治疗的情况:一项涉及 222 名 KarMMa-3 患者的随机开放标签研究和一项涉及 127 名 KarMMa 患者的单臂开放标签研究。
KarMMa-3 研究
本节描述的安全性数据反映了 KarMMa-3 研究中 ABECMA 的暴露情况,其中 222 例复发或难治性多发性骨髓瘤患者接受了 ABECMA,剂量范围为 175 至 529 x 10 6 CAR 阳性 T 细胞(中位剂量:445 x 10 6 CAR 阳性 T 细胞)[见临床研究(14) ]。有中枢神经系统疾病史或需要持续接受慢性免疫抑制治疗的患者被排除在外。安全性人群的中位年龄为 63 岁(范围:30 至 81 岁);43% 为 65 岁或以上,63% 为男性。47% 的患者基线时东部肿瘤协作组 (ECOG) 体能状态为 0 分、51% 的患者为 1 分、1.4% 的患者为 2 分和 0.5% 的患者为 3 分。接受 ABECMA 治疗的 4 名 (1.8%) 患者的肌酐清除率 <45 mL/min。有关研究人群的详细信息,请参阅临床研究 (14)。
最常见的(大于或等于 10%)3 级或 4 级非实验室不良反应是发热性中性粒细胞减少症(51%)和任何感染(16%)。
最常见的非实验室不良反应(发生率大于或等于 20%)包括 CRS、发热、任何感染、发热性中性粒细胞减少症、低丙种球蛋白血症、肌肉骨骼疼痛、低血压、感染 - 病原体不明、疲劳、心动过速、腹泻、恶心、头痛、脑病、呼吸困难和水肿。
43% 的患者出现严重不良反应。最常见的非实验室(大于或等于 5%)严重不良反应包括感染 - 病原体不明(10%)、肺炎(9%)、病毒感染(8%)、脑病(6%)、发热(6%)和败血症(5%)。9% 的患者出现致命不良反应。
表 3 总结了接受 ABECMA 治疗的患者中至少 10% 发生的不良反应。表 4 描述了最常见的 3 级或 4 级实验室异常。
表 3:KarMMa-3 研究中至少 10% 接受治疗的患者观察到的不良反应 |
||||
CAR=嵌合抗原受体。 |
||||
a凝血病包括活化部分凝血活酶时间延长、血纤维蛋白原降低、凝血病、弥漫性血管内凝血、低纤维蛋白原血症、国际标准化比值升高、凝血酶原时间延长。 |
||||
b心动过速包括心率加快、窦性心动过速、心动过速。 |
||||
d呕吐包括干呕、呕吐。 |
||||
e腹痛包括腹部不适、腹痛、下腹痛、上腹痛、消化不良。 |
||||
f疲劳包括乏力、疲劳、不适、肌肉疲劳。 |
||||
g水肿包括水肿、周围性水肿、全身性水肿、周围性肿胀、肿胀、眼睑水肿、面部水肿、液体潴留、血容量过多、局部性水肿、口肿胀、眶周水肿、眶周肿胀、面部肿胀。 |
||||
h感染和侵染系统器官类别不良事件按高级分组术语 (HLGT) 病原体类型分组。 |
||||
i上呼吸道感染包括急性鼻窦炎、会厌炎、HCoV-OC43感染、鼻咽炎、咽部炎症、咽炎、链球菌性咽炎、呼吸道感染、细菌性呼吸道感染、鼻炎、鼻病毒感染、鼻窦炎、上呼吸道感染、病毒性上呼吸道感染。 |
||||
j肺炎包括支气管肺曲霉病、冠状病毒性肺炎、COVID-19 肺炎、机化性肺炎、肺炎、不动杆菌性肺炎、腺病毒性肺炎、吸入性肺炎、细菌性肺炎、真菌性肺炎、流感性肺炎、军团菌性肺炎、副流感病毒性肺炎、假单胞菌性肺炎、链球菌性肺炎、病毒性肺炎、肺诺卡氏菌病。 |
||||
k肌肉骨骼疼痛包括关节痛、背痛、骨痛、关节僵硬、肌肉拉伤、肌肉骨骼胸痛、肌肉骨骼不适、肌肉骨骼疼痛、肌肉骨骼僵硬、肌痛、颈痛、非心源性胸痛。 |
||||
l头痛包括头痛、头部不适。 |
||||
m脑病包括遗忘症、认知障碍、精神错乱、意识水平下降、注意力障碍、书写障碍、脑病、免疫效应细胞相关神经毒性综合征、语无伦次、嗜睡、记忆力受损、精神状态改变、代谢性脑病、嗜睡、昏迷、中毒性脑病。 |
||||
o神经病变包括腕管综合征、感觉迟钝、感觉过敏、感觉减退、口腔感觉减退、单神经病、神经痛、神经炎、周围神经病、感觉异常、口腔感觉异常、周围运动神经病、周围感觉运动神经病、周围感觉神经病、腓神经麻痹、根性痛、神经根病、骶神经根病、坐骨神经痛、感觉丧失、毒性神经病。 |
||||
q肾衰竭包括急性肾损伤、血肌酐升高、慢性肾脏病、肌酐肾清除率降低、肾小球滤过率降低、肾病毒性、少尿、肾衰竭、肾功能损害、尿量减少。 |
||||
r呼吸困难包括呼吸困难、劳力性呼吸困难、阵发性夜间呼吸困难、呼吸急促。 |
||||
t缺氧包括缺氧、血氧饱和度降低。 |
||||
v皮疹包括痤疮、导管部位皮炎、导管部位皮疹、皮炎、接触性皮炎、药疹、湿疹、红斑、丘疹脓疱性酒渣鼻、光敏反应、皮疹、毛囊性皮疹、斑疹、斑丘疹性皮疹、丘疹性皮疹、瘙痒性皮疹、皮肤刺激、皮肤病变、荨麻疹。 |
||||
ABECMA (人数=222) |
标准方案(N=126) |
|||
任何等级 (%) |
3 或 4 年级 (%) |
任何等级 (%) |
3 或 4 年级 (%) |
|
血液和淋巴系统疾病 |
||||
发热性中性粒细胞减少症 |
51 |
51 |
二十八 |
二十八 |
凝血病 |
14 |
2.7 |
4.8 |
0.8 |
心脏疾病 |
||||
心动过速 |
三十二 |
0 |
21 |
0 |
胃肠道疾病 |
||||
腹泻c |
31 |
2.3 |
三十五 |
3.2 |
恶心 |
二十七 |
0.9 |
四十八 |
0 |
17 |
0 |
15 |
0 |
|
呕吐 |
14 |
0 |
17 |
0 |
腹痛 |
10 |
0.5 |
14 |
0 |
一般性疾病和给药部位情况 |
||||
发热 |
91 |
9 |
53 |
6 |
疲劳 |
33 |
1.4 |
四十八 |
4 |
水肿 |
20 |
0.5 |
二十八 |
2.4 |
寒冷 |
19 |
0.5 |
十三 |
0 |
免疫系统疾病 |
||||
细胞因子释放综合征 |
91 |
4.1 |
40 |
0.8 |
低丙种球蛋白血症 |
四十八 |
0.9 |
二十五 |
0 |
感染和侵染 |
||||
任何感染 |
56 |
16 |
64 |
18 |
感染 – 病原体不明 |
三十五 |
9 |
40 |
11 |
上呼吸道感染 |
19 |
1.8 |
17 |
0.8 |
感染 – 病毒性 |
18 |
5 |
二十八 |
6 |
感染 –细菌 |
15 |
4.5 |
19 |
8 |
肺炎 |
十三 |
8 |
十三 |
11 |
代谢和营养障碍 |
||||
食欲下降 |
17 |
1.8 |
21 |
0 |
肌肉骨骼和结缔组织疾病 |
||||
肌肉骨骼疼痛k |
三十六 |
1.8 |
49 |
8 |
神经系统疾病 |
||||
头痛 |
24 |
0 |
二十九 |
1.6 |
脑病 |
22 |
3.6 |
21 |
4.8 |
头晕 |
14 |
1.8 |
18 |
3.2 |
神经病变 |
10 |
0 |
21 |
0.8 |
精神疾病 |
||||
睡眠障碍p |
11 |
0 |
22 |
2.4 |
肾脏和泌尿系统疾病 |
||||
肾衰竭 |
十三 |
5 |
15 |
4 |
呼吸困难 |
21 |
1.8 |
31 |
2.4 |
咳嗽 |
14 |
0 |
21 |
0 |
缺氧 |
18 |
6 |
8 |
1.6 |
低血压 |
三十六 |
2.3 |
19 |
1.6 |
14 |
7 |
21 |
11 |
|
皮肤病 |
||||
皮疹v |
10 |
0 |
19 |
0.8 |
接受 ABECMA 治疗的患者中不到 10% 出现的其他具有临床重要性的不良反应包括:
•心脏疾病:心律失常(7%)
•胃肠道疾病:胃肠道出血(0.5%)
•免疫系统疾病:噬血细胞性淋巴组织细胞增生症(2.3%)
•感染和感染:感染 - 真菌(5%)、败血症( 6%)
•肌肉骨骼和结缔组织疾病:运动功能障碍b (9%)
•神经系统疾病:震颤c (4.1%)、失语症d (3.2%)、共济失调e (2.3%)、癫痫 (0.5%)
•精神疾病:焦虑症(4.1%)、谵妄症( 7%)
•呼吸、胸腔和纵隔疾病:肺水肿g (1.4%)
•血管疾病:血栓形成h (3.2%)
a脓毒症包括菌血症、细菌性脓毒症、念珠菌性脓毒症、柠檬酸杆菌性菌血症、梭菌性脓毒症、装置相关性菌血症、肠球菌性脓毒症、克雷伯氏菌血症、克雷伯氏菌性脓毒症、多器官功能障碍综合征、中性粒细胞减少性脓毒症、肺脓毒症、脓毒症、感染性休克、葡萄球菌性菌血症、链球菌性菌血症、链球菌性脓毒症。
b运动功能障碍包括静坐不能、运动障碍、发音障碍、肌张力亢进、肌肉痉挛、肌肉抽搐、肌肉无力、不安腿综合征。
c震颤包括头部摇晃,意向性震颤,静止性震颤,震颤。
e共济失调包括共济失调、平衡障碍、辨距障碍、步态障碍。
f谵妄包括激动、谵妄、定向障碍、幻觉、幻听、幻视、烦躁不安。
g肺水肿包括肺充血和肺水肿。
h血栓形成包括深静脉血栓形成、装置相关血栓形成、栓塞、肺栓塞、血栓形成、装置内血栓形成。
实验室异常
表 4 列出了根据实验室数据出现的最常见的 3 级或 4 级实验室异常,至少发生在 10% 的患者中。
表 4: KarMMa-3 研究中接受治疗的患者中至少 10% 出现3 级或 4 级实验室异常,且与基线相比有所恶化 |
||
CAR=嵌合抗原受体;CTCAE=不良事件常用术语标准;NCI=国家癌症研究所。 |
||
a实验室测试按照 NCI CTCAE 4.03 版进行分级。 |
||
实验室异常 |
澳大利亚机械工程师学会联合会 数量=222 (%) |
标准方案 数量=126 (%) |
3 级或 4 级(%) |
3 级或 4 级(%) |
|
淋巴细胞减少 |
98 |
78 |
白细胞减少 |
96 |
64 |
中性粒细胞减少 |
96 |
72 |
血小板减少 |
59 |
四十六 |
血红蛋白下降 |
52 |
四十五 |
磷酸盐减少 |
四十五 |
三十 |
甘油三酯升高 |
21 |
10 |
丙氨酸氨基转移酶升高 |
十三 |
8 |
钠减少 |
11 |
7 |
γ-谷氨酰转移酶升高 |
10 |
6 |
接受 ABECMA 治疗的患者中不到 10% 出现的其他具有临床意义的 3 级或 4 级实验室异常(基于实验室数据),包括:天冬氨酸氨基转移酶升高、钾降低、白蛋白降低、碱性磷酸酶升高、钙降低、葡萄糖升高、活化部分凝血活酶时间增加(秒)、纤维蛋白原降低、胆红素升高和低镁血症。
KarMMa 研究
本节描述的安全性数据反映了 KarMMa 研究中 ABECMA 的暴露情况,其中 127 名复发/难治性多发性骨髓瘤患者接受了 ABECMA 治疗,剂量范围为 150 至 518 × 10 6 CAR 阳性 T 细胞[见临床研究(14) ]。有中枢神经系统疾病史(如癫痫或脑血管缺血)或需要持续接受慢性免疫抑制治疗的患者被排除在外。随访中位时间为 11.4 个月。研究人群的中位年龄为 61 岁(范围:33 至 78 岁);35% 为 65 岁或以上,60% 为男性。45% 的患者基线时东部肿瘤协作组 (ECOG) 体能状态为 0 分,53% 的患者为 1 分,2% 的患者为 2 分。接受 ABECMA 治疗的患者中,7% 的肌酐清除率 <45 mL/min。有关研究人群的详细信息,请参阅临床研究 (14)。
最常见的(大于或等于 10%)3 级或 4 级非实验室不良反应是发热性中性粒细胞减少症(16%)和感染 - 病原体未指明(15%)。
最常见的非实验室不良反应(发生率大于或等于 20%)包括 CRS、感染 - 病原体未指明、疲劳、肌肉骨骼疼痛、低丙种球蛋白血症、腹泻、上呼吸道感染、恶心、病毒感染、脑病、水肿、发热、咳嗽、头痛和食欲下降。
67% 的患者出现严重不良反应。最常见的非实验室(大于或等于 5%)严重不良反应包括 CRS(18%)、一般身体健康状况恶化(10%)、肺炎(12%)、感染-病原体不明(19%)、病毒感染(9%)、败血症(7%)和发热性中性粒细胞减少症(6%)。6% 的患者出现致命不良反应。
表 5 总结了接受 ABECMA 治疗的患者中至少 10% 发生的不良反应。表 6 描述了最常见的 3 级或 4 级实验室异常。
表 5:KarMMa 研究中接受 ABECMA 治疗的患者中至少 10% 观察到的不良反应 |
||
CAR=嵌合抗原受体。a |
||
系统器官类别 |
ABECMA(CAR 阳性 T 细胞)的目标剂量 |
|
任何等级 |
3 年级或以上 |
|
[150~450×10 6 ] |
[150~450×10 6 ] |
|
血液和淋巴系统疾病 |
||
发热性中性粒细胞减少症 |
16 |
16 |
心脏疾病 |
||
心动过速 |
19 |
0 |
胃肠道疾病 |
||
腹泻 |
三十五 |
1.6 |
恶心 |
二十九 |
0 |
便秘 |
16 |
0 |
呕吐 |
15 |
0 |
口腔疼痛b |
12 |
0 |
一般性疾病和给药部位情况 |
||
疲劳 |
四十五 |
3.1 |
发热 |
二十五 |
1.6 |
整体身体健康状况恶化 |
11 |
10 |
水肿 |
二十五 |
0 |
寒冷 |
11 |
0 |
免疫系统疾病 |
||
细胞因子释放综合征 |
85 |
9 |
低丙种球蛋白血症 |
41 |
0.8 |
感染和侵染 |
||
感染 – 病原体不明 |
51 |
15 |
病毒感染 |
二十七 |
9 |
细菌感染 |
15 |
3.9 |
肺炎 |
17 |
9 |
上呼吸道感染 |
三十四 |
1.6 |
调查 |
||
体重减轻 |
十三 |
1.6 |
代谢和营养障碍 |
||
食欲下降 |
22 |
0.8 |
肌肉骨骼和结缔组织疾病 |
||
肌肉 骨骼疼痛 |
四十五 |
3.1 |
运动功能障碍 |
11 |
0 |
神经系统疾病 |
||
脑病l |
二十六 |
6 |
头痛 |
23 |
0 |
头晕 |
17 |
0.8 |
17 |
0.8 |
|
震颤 |
10 |
0 |
精神疾病 |
||
失眠问 |
十三 |
0 |
焦虑 |
12 |
0.8 |
肾脏和泌尿系统疾病 |
||
肾衰竭 |
10 |
2.4 |
呼吸、胸腔和纵隔疾病 |
||
咳嗽 |
23 |
0 |
呼吸困难 |
十三 |
2.4 |
皮肤和皮下组织疾病 |
||
皮疹v |
14 |
0.8 |
干燥症 |
11 |
0 |
血管疾病 |
||
低血压x |
17 |
0 |
高血压 |
11 |
3.1 |
接受 ABECMA 治疗的患者中不到 10% 出现的其他具有临床重要性的不良反应包括:
•血液和淋巴系统疾病:凝血病a (9%)
•胃肠道疾病:胃肠道出血c (3.1%)
•免疫系统疾病:噬血细胞性淋巴组织细胞增生症(3.1%)
•感染和侵染:真菌感染(8%)、败血症( 9%)
•神经系统疾病:失语症e (7%)、共济失调f (3.1%)、轻瘫g (2.4%)、癫痫 (1.6%)
•精神疾病:谵妄h (6%)
•呼吸、胸腔和纵隔疾病:缺氧(2.4%)、肺水肿(2.4%)
•血管疾病:血栓形成i (3.1%)
a凝血病包括活化部分凝血活酶时间延长、抗凝药物浓度超过治疗浓度、弥漫性血管内凝血、国际标准化比值升高。b心肌
病包括应激性心肌病、心室肥大。c消化道出血包括消化道出血、痔疮出血、黑便。d脓毒症包括菌血症、肠球菌菌血症、大肠杆菌菌血症、脓毒症、感染性休克、沙雷氏菌菌血症、链球菌菌血症。e
失语包括失语、构音障碍。f共济失调包括共济失调、步态障碍、Romberg 试验阳性。g轻瘫包括脑神经障碍、偏瘫。h谵妄包括谵妄、定向障碍、幻觉。i血栓形成包括深静脉血栓形成、颈静脉血栓形成、门静脉血栓形成、肺栓塞。
实验室异常
表 6 列出了根据实验室数据出现的最常见的 3 级或 4 级实验室异常,至少发生在 10% 的患者中。
表 6: KarMMa 研究中接受 ABECMA 治疗的患者中至少 10% 的患者出现3 级或 4 级实验室异常,且较基线时恶化 |
|
|---|---|
实验室异常 |
剂量=[150 至 450 × 10 6 CAR-阳性T细胞] |
a NCI CTCAE=不良事件通用术语标准 4.03 版。aPTT |
|
3 级或 4 级(%) |
|
中性粒细胞减少 |
96 |
白细胞减少 |
96 |
淋巴细胞减少 |
92 |
血小板减少 |
63 |
血红蛋白下降 |
63 |
磷酸盐减少 |
四十五 |
钠减少 |
10 |
aPTT 增加(秒) |
10 |
接受 ABECMA 治疗的患者中不到 10% 出现的其他具有临床意义的 3 级或 4 级实验室异常(基于实验室数据),包括:丙氨酸氨基转移酶升高、天冬氨酸氨基转移酶升高、白蛋白降低、碱性磷酸酶升高、葡萄糖升高、钾降低、胆红素升高、纤维蛋白原降低和钙降低。
6.2 免疫原性
ABECMA 有可能诱发抗产品抗体。在临床研究中,ABECMA 的体液免疫原性是通过测定给药前和给药后血清中的抗 CAR 抗体来测量的。在临床研究中,2.6% 的患者 (9/349) 在输注前检测出抗 CAR 抗体呈阳性,53% (186/349) 的患者检测到治疗诱导的抗 CAR 抗体。尚未发现预先存在或输注后抗 CAR 抗体对 ABECMA 的细胞扩增、安全性或有效性有临床显著影响。
6.3 上市后经验
由于所销售产品的不良事件都是由人数不确定的群体自愿报告的,因此并不总是能够准确地估计其发生频率或建立与产品暴露的因果关系。
ABECMA 上市后使用期间发现了以下不良事件:
神经系统疾病:免疫效应细胞相关神经毒性综合征(ICANS)。
针对 BCMA 或 CD19 的基因改造自体 T 细胞免疫疗法上市后使用过程中发现了以下不良事件:
肿瘤: T 细胞恶性肿瘤。
7. 药物相互作用
药物/实验室测试相互作用
HIV 和用于制造 ABECMA 的慢病毒具有相同遗传物质 (RNA) 的有限且短的跨度。因此,一些商用 HIV 核酸检测可能会在接受 ABECMA 的患者中产生假阳性结果。
8. 特定人群的使用
8.1 怀孕
风险摘要
目前尚无关于孕妇使用 ABECMA 的可用数据。尚未对 ABECMA 进行动物生殖和发育毒性研究,以评估其在给孕妇使用时是否会对胎儿造成伤害。
目前尚不清楚 ABECMA 是否有可能转移给胎儿。根据作用机制,如果转导细胞穿过胎盘,则可能导致胎儿毒性,包括浆细胞发育不全或低丙种球蛋白血症。因此,不建议怀孕的女性使用 ABECMA,输注 ABECMA 后怀孕应与治疗医生讨论。评估接受 ABECMA 治疗的母亲的新生儿的免疫球蛋白水平。
上述人群发生重大出生缺陷和流产的估计背景风险尚不清楚。美国普通人群发生重大出生缺陷的估计背景风险为临床确诊妊娠的 2% 至 4%,流产的估计背景风险为 15% 至 20%。
8.2 哺乳
风险摘要
目前尚无关于 ABECMA 是否出现在人乳中、对母乳喂养婴儿的影响以及对产奶量的影响的信息。应考虑母乳喂养对发育和健康的益处,以及母亲对 ABECMA 的临床需求以及 ABECMA 或潜在母体疾病对母乳喂养婴儿的任何潜在不利影响。
8.3 具有生育能力的女性和男性
妊娠测试
在开始使用 ABECMA 治疗之前,应通过妊娠测试验证具有生育能力的性活跃女性的妊娠状况。
避孕
有关接受淋巴细胞清除化疗的患者是否需要有效避孕的信息,请参阅氟达拉滨和环磷酰胺的处方信息。
没有足够的暴露数据来提供有关 ABECMA 治疗后避孕持续时间的建议。
不孕不育
目前还没有关于 ABECMA 对生育力影响的数据。
8.4 儿科用途
ABECMA 对 18 岁以下患者的安全性和有效性尚未确定。
8.5 老年人使用
在 ABECMA 的临床试验中,349 名患者中有 141 名(40%)年龄在 65 岁及以上,16 名(4.6%)患者年龄在 75 岁及以上。在 KarMMa 研究中,所有 5 例 3 级神经毒性均发生在年龄≥ 65 岁(66 至 74 岁)的患者中。这些患者与 65 岁以下患者之间未观察到 ABECMA 有效性的临床重要差异。
11.Abecma 描述
ABECMA 是一种 BCMA 导向的转基因自体 T 细胞免疫治疗产品,由患者自身的 T 细胞组成,这些 T 细胞是通过抗 BCMA02 嵌合抗原受体 (CAR) 慢病毒载体 (LVV) 转导而体外收获和转基因的。用抗 BCMA02 CAR LVV 转导的自体 T 细胞在 T 细胞表面表达抗 BCMA CAR。CAR 由小鼠胞外单链可变片段 (scFv) 组成,该片段专门用于识别 B 细胞成熟抗原 (BCMA),随后是人类 CD8α 铰链和跨膜结构域,该结构域与 CD137 (4-1BB) 和 CD3ζ 链的 T 细胞胞质信号结构域串联融合。ABECMA 与表达 BCMA 的靶细胞结合会导致由 CD3ζ 和 4-1BB 结构域启动的信号传导,以及随后的 CAR 阳性 T 细胞活化。 ABECMA 的抗原特异性激活会导致 CAR 阳性 T 细胞增殖、细胞因子分泌以及随后的 BCMA 表达细胞的细胞溶解性杀伤。
ABECMA 是从患者的外周血单核细胞 (PBMC) 制备的,这些细胞是通过标准白细胞分离术获得的。通过在 IL-2 存在下用抗 CD3 和抗 CD28 抗体激活,单核细胞中富集 T 细胞,然后用含有抗 BCMA CAR 转基因的复制缺陷型慢病毒载体进行转导。转导的 T 细胞在细胞培养中扩增、清洗、配制成悬浮液并冷冻保存。产品必须通过无菌测试,然后才能作为冷冻悬浮液装在一个或多个患者专用输液袋中运输。产品在输回患者体内之前需要解冻[见用法与用量 (2.3)和供应方式/储存和处理 (16) ]。
ABECMA 配方含有 50% Plasma-Lyte A 和 50% CryoStor ® CS10,因此最终 DMSO 浓度为 5%。
12. Abecma-临床药理学
12.1 作用机制
ABECMA 是一种嵌合抗原受体 (CAR) 阳性 T 细胞疗法,靶向 B 细胞成熟抗原 (BCMA),该抗原在正常和恶性浆细胞表面表达。CAR 构建体包括用于抗原特异性的抗 BCMA scFv 靶向域、跨膜域、CD3-zeta T 细胞活化域和 4-1BB 共刺激域。ABECMA 的抗原特异性激活会导致 CAR 阳性 T 细胞增殖、细胞因子分泌,以及随后对表达 BCMA 的细胞进行细胞溶解性杀伤。
12.2 药效学
输注 ABECMA 后,评估了 CAR 激活和抗肿瘤功效的药效学反应。输注 ABECMA 后 14 天内血浆细胞因子、趋化因子和可溶性免疫介质达到峰值,并在一个月内恢复到基线水平。
在 ABECMA 输注后的第一个月内观察到与临床反应相关的肿瘤标志物迅速下降,包括可溶性 BCMA 的血清水平和骨髓 CD138+ 细胞,以及微小残留疾病 (MRD) 阴性反应。
12.3 药代动力学
输注 ABECMA 后,CAR 阳性 T 细胞增殖并经历快速多对数扩增,随后经历双指数下降。外周血中最大扩增的中位时间 (T max ) 发生在输注后 11 天。
ABECMA 输注后可在外周血中持续存在长达 1 年。表 7 提供了 KarMMa 和 KarMMa-3 的T max、AUC0-28days 和 C max的摘要。
表 7:复发/难治性多发性骨髓瘤患者中 ABECMA 的药代动力学参数 |
|||
AUC 0-28days = 从给药时间到输注后 28 天的转基因水平曲线下面积;C max = 最大转基因水平;ddPCR = 液滴数字聚合酶链式反应;qPCR = 定量聚合酶链式反应;PK = 药代动力学;T max = 观察到的最大转基因水平的时间。a |
|||
药代动力学参数 |
统计摘要 |
KarMMa 研究 总计 CAR-阳性T细胞 (通过 qPCR 定量) |
KarMMa-3 研究 全部的 [300 至 510 x 106 ] CAR-阳性T细胞 (通过 ddPCR 定量)b |
最大温度(天) |
中位数(范围) |
11(7-28) |
11(4-31) 数量 = 207 |
C最大值(份数/微克) |
几何平均值(几何 CV%) |
256,333(165) 人数 = 99 |
117,557(215) 数量 = 207 |
AUC 0-28 天 |
几何平均值(几何 CV%) |
3,088,455(190) |
1,098,862(228) 人数 = 205 |
ABECMA 转基因水平与客观肿瘤反应(部分反应或更好)呈正相关。在 KarMMa 中接受 ABECMA 治疗的患者中,反应者(N = 72)的 C max中位水平比无反应者(N = 27)的相应水平高出约 4.6 倍。反应者(N = 72)的0-28 天AUC 中位水平比无反应者(N = 26)的相应水平高出约 5.6 倍。在 KarMMa-3 中接受 ABECMA 治疗的患者中,反应者(N = 172)的 C max中位水平比无反应者(N = 35)的相应水平高出约 6.5 倍。反应者(N = 172)的0-28 天AUC中位水平比无反应者(N = 33)的相应水平高出约 6.1 倍。
托珠单抗或 Siltuximab 和皮质类固醇的使用
部分患者需要使用托珠单抗或西妥昔单抗和/或皮质类固醇治疗 CRS。使用托珠单抗或西妥昔单抗或皮质类固醇后,ABECMA 可继续扩增并持续存在[见警告和注意事项 (5.2) ]。
在 KarMMa 中,与未接受托珠单抗治疗的患者相比,接受托珠单抗治疗的 CRS 患者的 ABECMA 细胞扩增水平更高,中位 C max (N = 67) 和 AUC 0-28 天(N = 66) 分别高出 1.3 倍和 1.6 倍 (C max为 N = 59 ,AUC 0-28 天为 N = 58 )。
与未接受皮质类固醇治疗的患者相比,接受皮质类固醇治疗的 CRS 患者的 ABECMA 细胞扩增水平更高,中位 C max (N = 18) 和 AUC 0-28 天(N = 18) 分别高出 1.7 倍和 2.2 倍 (C max为 N = 108 ,AUC 0-28 天为 N = 106 )。
在 KarMMa-3 中也观察到了类似的趋势。
特定人群
老年
年龄(范围:30 至 81 岁)对扩展参数没有显著影响[见特殊人群中的使用(8.5) ]。
儿科
尚未评估 18 岁以下患者中 ABECMA 的药代动力学。
肝肾功能不全患者
尚未进行 ABECMA 的肝、肾功能损害研究。
有其他内在因素的患者
性别、种族和民族对 ABECMA 扩张参数没有显著影响。体重较轻的患者扩张速度较快。由于药代动力学细胞扩张变化较大,体重对 ABECMA 药代动力学的总体影响被认为与临床无关。
13. 非临床毒理学
13.1 致癌作用、致突变作用、生育能力受损
尚未对 ABECMA 进行啮齿动物遗传毒性试验和致癌性研究。
使用来自五名患者和两批健康供体药物产品的 CAR 阳性 T 细胞 (ABECMA) 进行的体外扩增研究未显示 T 细胞转化和/或永生化的证据。对来自二十 (20) 名患者供体的 ABECMA 样本进行了慢病毒载体的基因组插入位点分析。没有证据表明在关注基因附近有优先整合,也没有证据表明含有关注整合位点的细胞有优先生长。
尚未进行有关 ABECMA 对生育力的影响的研究。
14. 临床研究
接受过两至四种疗法治疗后复发/难治性多发性骨髓瘤
KarMMa-3 (NCT03651128) 评估了 ABECMA 的疗效,这是一项开放标签、多中心、随机对照研究,研究对象为复发和难治性多发性骨髓瘤成年患者,这些患者曾接受过两至四种抗骨髓瘤疗法,包括免疫调节剂、蛋白酶体抑制剂和达雷木单抗,并且对最近的抗骨髓瘤疗法有耐药性。研究包括对至少 1 种先前治疗方案有反应(最小反应或更好)且 ECOG 体能状态为 0 或 1 的患者。研究排除了血清肌酐清除率 <45 mL/min、血清天冬氨酸氨基转移酶 (AST) 或丙氨酸氨基转移酶 (ALT) >正常上限 2.5 倍、左心室射血分数 (LVEF) <45% 的患者。如果患者骨髓有核细胞中 <50% 为浆细胞,且绝对中性粒细胞计数 <1000/µL 且血小板计数 <75,000/μL,则也被排除在外;如果患者骨髓有核细胞中≥50% 为浆细胞,且血小板计数 <50,000/μL,则也被排除在外。
总共有 386 名患者按 2:1 的比例随机接受 ABECMA(N=254)或标准方案(N=132)。标准方案包括达雷木单抗、泊马度胺、地塞米松 [DPd]、达雷木单抗、硼替佐米、地塞米松 [DVd]、伊沙佐米、来那度胺、地塞米松 [IRd]、卡非佐米、地塞米松 [Kd] 或埃罗妥珠单抗、泊马度胺、地塞米松 [EPd]),由研究者在随机分组前根据患者最近的抗骨髓瘤治疗情况进行选择。随机分组按年龄、既往抗骨髓瘤方案数量和是否存在高风险细胞遗传学异常进行分层。
随机接受 ABECMA 治疗的患者将从 ABECMA 的目标输注日期前 5 天开始接受淋巴细胞清除化疗,包括环磷酰胺(300 mg/m 2静脉输注,每日 3 天)和氟达拉滨(30 mg/m 2静脉输注,每日 3 天)。根据患者最近的抗骨髓瘤治疗方案,在白细胞分离术和开始淋巴细胞清除化疗前 14 天之间允许进行最多 1 个周期的 DPd、DVd、IRd、Kd 或 EPd 桥接治疗以控制疾病。
在随机接受 ABECMA 治疗的 254 名患者中,249 名 (98%) 患者接受了白细胞分离术:
•五名 (2%) 患者因退出 (n=2)、不良事件 (n=1) 或未能满足淋巴细胞清除化疗治疗标准 (n=2) 而未接受白细胞分离术。
•24 名 (10%) 患者未接受 ABECMA,原因是死亡 (n=4)、不良事件 (n=4)、医生决定 (n=7)、未能满足淋巴细胞清除化疗治疗标准 (n=6) 或无法制造产品 (n=3)。
•三名(1.2%)患者接受的 CAR 阳性 T 细胞不符合 ABECMA 的产品放行规范(不合格产品;n=3)。
接受白细胞分离术的患者的整体制造失败率为 2.4%(249 名患者中有 6 名)。在这 6 名患者中,有 3 名患者接受的 CAR 阳性 T 细胞不符合 ABECMA 的产品发布规范,还有 3 名患者无法制造 ABECMA。
大多数接受 ABECMA 治疗的患者 (85%) 在制造过程中接受了桥接疗法以控制多发性骨髓瘤。从白细胞分离术到产品可用的中位时间为 35 天(范围:24 至 102 天)。
总体研究人群中,中位年龄为 63 岁(范围:30 至 83 岁),61% 为男性,65% 为白人,9.3% 为黑人,3.1% 为亚洲人。大多数患者(80%)为修订国际分期系统 (R-ISS) I 期或 II 期。42% 的患者存在高危细胞遗传学 [存在 t(4:14)、(14:16) 和 17p13 del]。24% 的患者存在髓外疾病。
既往接受过 3 种治疗的中位数为 3(范围:2 至 4)。30% 的患者既往接受过 2 种治疗,37% 的患者既往接受过 3 种治疗,32% 的患者既往接受过 4 种治疗。95% 的患者对抗 CD38 单克隆抗体有耐药性。66% 的患者对三类药物有耐药性(对 PI、IMiD 和抗 CD38 单克隆抗体有耐药性),5% 的患者对五类药物有耐药性(对 2 种 PI、2 种 IMiD 药物和抗 CD38 单克隆抗体有耐药性)。85% 的患者既往接受过自体干细胞移植。
主要疗效指标为独立审查委员会 (IRC) 根据国际骨髓瘤工作组 (IMWG) 多发性骨髓瘤统一疗效标准2确定的无进展生存期 (PFS) 。其他疗效指标包括总体缓解率 (ORR) 和总体生存期 (OS)。疗效结果总结于表 8,PFS 的 Kaplan-Meier 曲线如图 2 所示。
初步 PFS 分析估计的中位随访时间为 15.9 个月(95% CI:14.1,18.0)。
表 8:KarMMa-3 疗效结果总结(意向治疗人群) |
||
CI=置信区间;CR=完全缓解;MRD=微小残留疾病;PR=部分缓解;sCR=严格完全缓解;VGPR=非常好的部分缓解。a |
||
e 根据分层因素分层的 Cochran-Mantel-Haenszel (CMH) 检验的单侧 p 值。 |
||
ABECMA 臂 (样本量=254) |
标准方案组 (样本量=132) |
|
无进展生存期 (PFS) |
||
事件数,n (%) |
149(59) |
93(70) |
中位数,月数 [95% CI] a |
13.3 [11.8, 16.1] |
4.4 [3.4, 5.9] |
风险比 [95% 可信区间] b |
0.49 [0.38, 0.64] |
|
单侧 p 值c |
< 0.0001 |
|
总体缓解率 (ORR),n (%) |
||
含量(%) |
181(71) |
55(42) |
95% 可信区间 (% ) |
(66,77) |
(33, 50) |
单侧 p 值e |
< 0.0001 |
|
CR 或更好 (sCR+CR) |
98(39) |
7 (5) |
可控硅 |
90(35) |
6(4.5) |
碳排放 |
8(3.1) |
1(0.8) |
垂直探地雷达 |
55(22) |
13(10) |
公共关系 |
28(11) |
35(27) |
图 2:IRC 评估无进展生存期的 Kaplan-Meier 图(意向治疗分析)
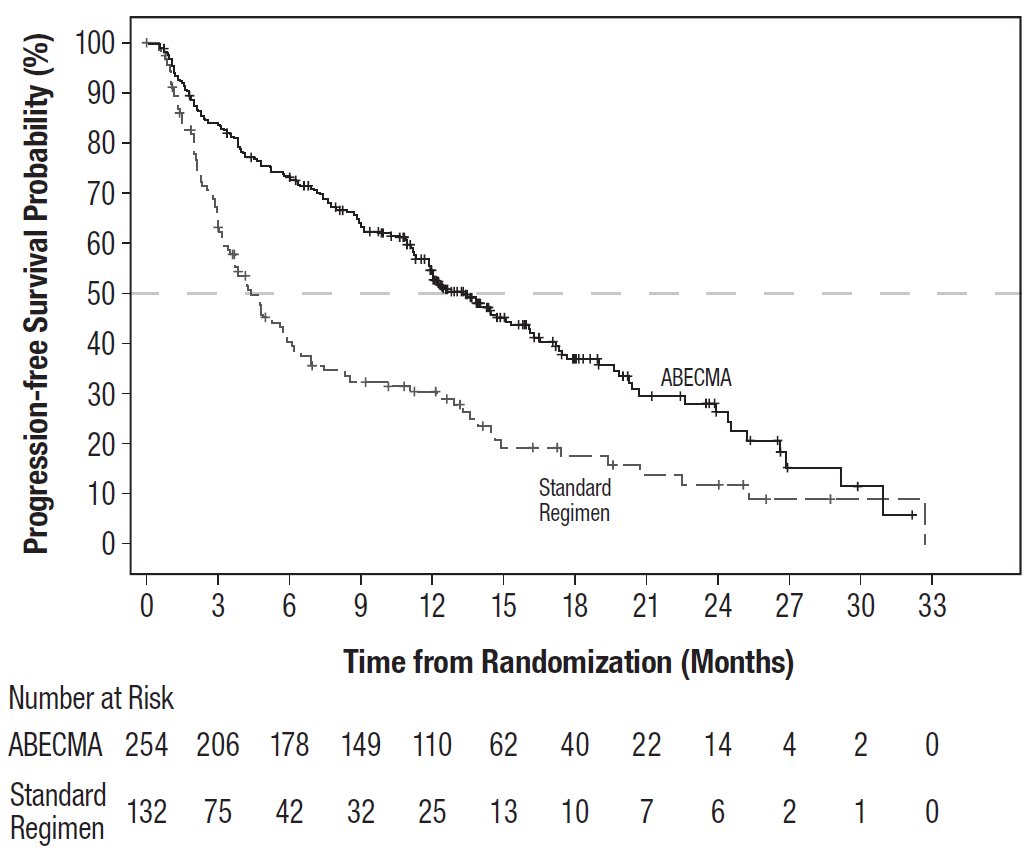
数据截止日期:2022 年 4 月 18 日
在 ABECMA 组中,部分缓解 (PR) 或更好的患者的中位缓解持续时间 (DOR) 为 14.8 个月 (95% CI: 12.0, 18.6)。在 CR 或更好的患者中,中位 DOR 为 20 个月 (95% CI: 15.8, 24.3)。
如图 3 所示,与标准方案组相比,ABECMA 组患者在随机分组后的前九个月内死亡的比例更高。
图 3:第二次中期分析时总生存率的 Kaplan-Meier 图(意向治疗分析)
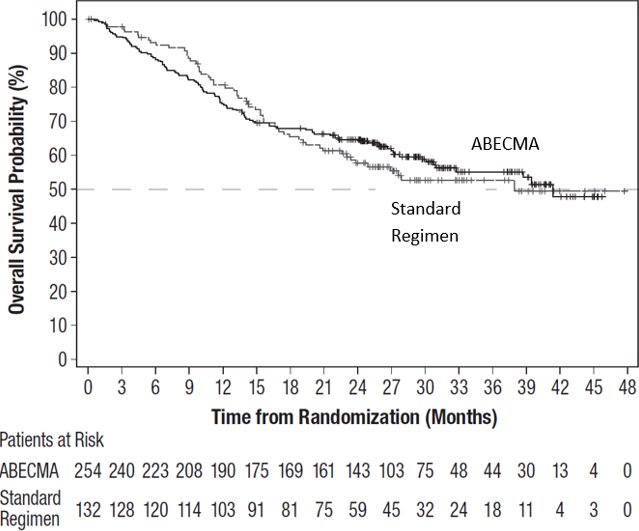
数据截止日期:2023年4月28日。
74% 的计划 OS 事件已经发生。74 名患者 (56%) 从标准方案组转至 ABECMA 组。
OS 曲线在研究的第 15 个月交叉,导致总体风险比不可靠,无法估计治疗对 OS 的影响。
接受过三线或三线以上治疗后复发/难治性多发性骨髓瘤
KarMMa (NCT03361748) 评估了 ABECMA 的疗效,这是一项开放标签、单组、多中心研究,研究对象为复发和难治性多发性骨髓瘤成年患者,这些患者之前至少接受过 3 种抗骨髓瘤疗法,包括免疫调节剂、蛋白酶体抑制剂和抗 CD38 单克隆抗体。研究纳入了 ECOG 体能状态为 0 或 1 的患者。研究排除了肌酐清除率小于或等于 45 mL/分钟、丙氨酸氨基转移酶 > 正常上限的 2.5 倍和左心室射血分数 <45% 的患者。如果绝对中性粒细胞计数 <1000 个细胞/mm 3且血小板计数 <50,000/mm 3 ,患者也被排除在外。患者入组时根据 IMWG 2016 标准有可测量的疾病。在白细胞分离术之间直至淋巴细胞清除化疗开始前 14 天,允许使用患者之前接触过的烷化剂、皮质类固醇、免疫调节剂、蛋白酶体抑制剂和/或抗 CD38 单克隆抗体进行桥接治疗以控制疾病。
淋巴细胞清除化疗包括环磷酰胺(300 mg/m 2静脉输注,每日 3 天)和氟达拉滨(30 mg/m 2静脉输注,每日 3 天),从 ABECMA 目标输注日期前 5 天开始。氟达拉滨剂量因肾功能不全而减少。患者在 ABECMA 输注后住院 14 天,以监测潜在的 CRS、HLH/MAS 和神经毒性。
在接受 300 x 10 6和 450 x 10 6 CAR 阳性 T 细胞剂量组白细胞分离术的 135 名患者中:
•11 名 (8%) 患者未接受 CAR 阳性 T 细胞治疗,原因是死亡 (n=2)、不良事件 (n=1)、疾病进展 (n=1)、撤回同意 (n=3)、医生决定 (n=3) 或无法制造产品 [制造失败 (n=1)]。两名患者在接受淋巴细胞清除后、接受 ABECMA 治疗前死亡。死亡原因是感染性休克和全身健康状况恶化。
•24 名患者(18%)接受了 300 至 460 x 10 6 个CAR 阳性 T 细胞剂量范围之外的 ABECMA(n=23),或者接受了不符合 ABECMA 产品放行规范的 CAR 阳性 T 细胞(不合格产品;n=1)。
•疗效可评估人群包括 100 名患者(74%),他们接受 ABECMA 剂量范围为 300 至 460 x 10 6 CAR 阳性 T 细胞。
接受 300 x 10 6和 450 x 10 6 CAR 阳性 T 细胞剂量组白细胞分离术的患者总体制造失败率为 1.5%(135 名患者中有 2 名)。在这两名患者中,一名患者接受的 CAR 阳性 T 细胞不符合 ABECMA 产品发布规范,一名患者无法制造 ABECMA。
在疗效可评估人群中的 100 名患者中,中位年龄为 62 岁(范围:33 至 78 岁),60% 为男性,78% 为白人,6% 为黑人,2% 为亚洲人。大多数患者(78%)为国际分期系统 (ISS) I 期或 II 期。37% 的患者存在高危细胞遗传学(存在 t(4:14)、t(14:16) 和 17p13 del)。36% 的患者存在髓外疾病。
既往治疗的中位数为 6(范围:3 至 16),88% 的患者接受过 4 种或更多种既往治疗。95% 的患者对抗 CD38 单克隆抗体有耐药性。85% 的患者为三类耐药性(对蛋白酶体抑制剂 [PI]、免疫调节药物 [IMiD] 和抗 CD38 单克隆抗体有耐药性),26% 的患者为五类耐药性(对 2 种 PI、2 种 IMiD 药物和抗 CD38 单克隆抗体有耐药性)。92% 的患者曾接受过自体干细胞移植。
大多数接受 ABECMA 治疗的患者 (87%) 在制造过程中接受了桥接疗法以控制多发性骨髓瘤。从白细胞分离术到产品可用的中位时间为 33 天(范围:26 至 49 天)。
疗效是根据国际骨髓瘤工作组 (IMWG) 多发性骨髓瘤统一疗效标准,由独立疗效委员会 (IRC) 评估,以总体反应率 (ORR)、完全反应率 (CR) 和反应持续时间 (DOR) 为基础确定的。
300 至 460 x 10 6 CAR阳性T细胞剂量范围的疗效结果如表9和表10所示,DOR结果如表11所示。首次应答的中位时间为30天(范围:15至88天)。
表 9:根据 IMWG 标准进行的独立反应委员会审查的疗效总结(KarMMa 研究) |
|
CAR=嵌合抗原受体;CI=置信区间;CR=完全缓解;MRD=微小残留病;IMWG=国际骨髓瘤工作组;PR=部分缓解;sCR=严格完全缓解;VGPR=非常好的部分缓解。a |
|
ABECMA 治疗人群(300 至 460 x 10 6 个CAR 阳性 T 细胞) 数量=100 |
|
总体缓解率(sCR a +VGPR+PR),n (%) 95% 可信区间b (%) |
72(72) 62, 81 |
sCR a ,n (%) 95% 可信区间b (%) |
28(28) 19, 38 |
峰值速率比率,n (%) 95% 可信区间b (%) |
25(25) 17, 35 |
PR,n(%) 95% 可信区间b (%) |
19(19) 12, 28 |
表 10:KarMMa 研究中 MRD 阴性率 |
|
a MRD 阴性定义为在达到 CR 或严格 CR之前三个月内直至进展或死亡时任何时间点为 CR 或严格 CR 的患者比例。b |
|
所有接受治疗的患者中的MRD c -阴性率a (n=100) 95% 可信区间b (%) |
21(21) 13, 30 |
达到 CR 或 sCR 状态的患者的MRD c阴性率a (%) (n=28) 95% 可信区间 |
21(75) 55, 89 |
表 11:KarMMa 研究中的反应持续时间 |
|
CAR=嵌合抗原受体;CI=置信区间;CR=完全缓解;PR=部分缓解;sCR=严格完全缓解;VGPR=非常好的部分缓解;NE=不可估计。a根据 IMWG 标准, |
|
ABECMA 治疗人群(300 至 460 x 106 数量=100 |
|
反应持续时间a,b(PR 或更好) n 中位数(月) 95% 置信区间 |
11.0 10.3、11.4 |
sCR 的缓解持续时间b n 中位数(月) 95% 置信区间 |
19.0 11.4,东北 |
缓解持续时间 (DOR) 的中位随访时间 |
10.7个月 |
与 PR 或 VGPR 患者相比,达到严格 CR 的患者的缓解持续时间更长(表 11)。在 28 名达到严格 CR 的患者中,估计有 65%(95% CI:42%,81%)的缓解持续至少 12 个月。
VGPR 患者(n=25)的中位反应持续时间为 11.1 个月(95% CI:8.7,11.3)。
PR 患者(n=19)的中位反应持续时间为 4.0 个月(95% CI:2.7,7.2)。
在推荐剂量300至460 x 10 6 CAR-T细胞治疗中,与接受300至340 x 10 6 CAR -T细胞治疗的患者的ORR和sCR率相比,接受440至460 x 10 6 CAR-T细胞治疗的患者的ORR和sCR率更高,呈现出剂量反应关系。440至460 x 10 6 CAR-T细胞治疗的总体缓解率为79%(95% CI:65%,90%),sCR率为31%(95% CI:19%,46%)。300至340 x 10 6 CAR -T细胞治疗的总体缓解率为65%(95% CI:51%,78%),sCR率为25%(95% CI:14%,39%)。
135 名患者接受了白细胞分离术。在 23 名接受推荐剂量范围 300 至 460 x 10 6 CAR 阳性 T 细胞治疗的患者中,有 15 名除了表 9 中列出的反应外还出现了反应。IRC 评估的白细胞分离术人群(n=135)的总体反应率为 64%(95% CI:56%,72%),严格的 CR 率为 24%(95% CI:17%,32%),VGPR 率为 21%(95% CI:14%,29%),PR 率为 20%(95% CI:14%,28%)。
15. 参考文献
1.Lee DW、Gardner R、Porter DL 等。细胞因子释放综合征诊断和管理的最新概念。Blood 2014;124(2):188-95。Blood 勘误表:2015;126(8):1048。和 2016;128(11):1533。
2.Kumar S, Paiva B, Anderson KC 等。国际骨髓瘤工作组关于多发性骨髓瘤疗效和微小残留病评估的共识标准。Lancet Oncol 2016;17(8): e328-46。
16. Abecma 如何供应
ABECMA 装在一个或多个输液袋中(见下文),其中包含 5% DMSO 中的转基因自体 T 细胞的冷冻悬浮液。
每袋ABECMA输液袋均单独包装在金属盒内。ABECMA储存在液氮气相中,并装在液氮干气运输箱内。运输箱内贴有RFI证书。
•50 mL 输液袋和金属盒(NDC 59572-515-01)
•250 毫升输液袋和金属盒(NDC 59572-515-02)
•500 mL 输液袋及金属盒(NDC 59572-515-03)
在收到后,将患者的身份与盒式磁带和输液袋上的患者标识符进行匹配。
将 ABECMA 冷冻储存在液氮蒸气相中(小于或等于零下 130°C)。
输注前解冻 ABECMA [见剂量和给药(2.2) ]。
17. 患者咨询信息
建议患者阅读 FDA 批准的患者标签(用药指南)。
告知患者制造失败的风险为 2.1% [临床研究中为 8/384]。如果制造失败,可以尝试第二次制造 ABECMA。此外,在患者等待产品期间,可能需要进行额外的抗癌治疗(不是淋巴细胞清除),这可能会增加输注前期间发生不良事件的风险,从而延迟或阻止 ABECMA 的给药。
告知患者早期死亡风险:在一项临床研究中,与标准方案组相比,ABECMA 组随机分组后前 9 个月内死亡的患者比例更高。这种较高的早期死亡率主要出现在接受 ABECMA 治疗之前,主要原因是多发性骨髓瘤进展。接受 ABECMA 治疗后,不良事件导致的死亡率也有所增加。
建议患者如出现以下情况应立即就医:
•细胞因子释放综合征 (CRS):与 CRS 相关的体征或症状,包括发烧、低血压、心动过速、发冷、缺氧、头痛和疲劳[见用法和用量 (2.3)、警告和注意事项 (5.2)和不良反应 (6.1) ]。
•神经系统毒性:与神经系统事件相关的体征或症状,包括脑病、精神错乱、癫痫、震颤、失语、谵妄和嗜睡[见用法和用量(2.3)、警告和注意事项(5.3)和不良反应(6.1) ]。
•感染:与感染相关的体征或症状[见警告和注意事项(5.7)和不良反应(6.1) ]。
•长期血细胞减少:与骨髓抑制相关的体征或症状,包括中性粒细胞减少、贫血、血小板减少或发热性中性粒细胞减少[见警告和注意事项(5.8)和不良反应(6.1) ]。
•继发性恶性肿瘤:已经发生继发性恶性肿瘤,包括T 细胞恶性肿瘤[见黑框警告、警告和注意事项(5.10)、不良反应(6.3) ]。
建议患者需要:
•如果被诊断出患有继发性恶性肿瘤,请拨打 1-888-805-4555 联系百时美施贵宝公司(见警告和注意事项(5.10))。
•在 ABECMA 输注之前和之后定期监测血细胞计数[见警告和注意事项(5.8) ]。
•在服用 ABECMA 后至少八周内,请勿驾驶或操作重型或潜在危险的机器[见警告和注意事项 (5.11) ]。
制造商:Celgene Corporation,百时美施贵宝公司
556 Morris Avenue
Summit, NJ 07901
美国执照编号 2252
营销商:Celgene Corporation、百时美施贵宝公司(新泽西州萨米特 07901)和 2seventy bio, Inc.(马萨诸塞州剑桥 02142)。
ABECMA ®是 Celgene Corporation(百时美施贵宝公司)的商标。
专利。https://www.bms.com/patient-and-caregivers/our-medicines.html
ABEPI.004/MG.002
用药指南 |
|---|
本用药指南已获得美国食品药品管理局批准。 |
在开始 ABECMA 治疗之前,请阅读本用药指南。您对治疗了解得越多,您在护理方面就能越积极。如果您对您的健康状况或治疗有任何疑问,请咨询您的医疗保健提供者。阅读本用药指南不能代替与您的医疗保健提供者讨论您的治疗。 |
关于 ABECMA 我应该知道的最重要的信息是什么? •呼吸困难 •发烧(100.4°F/38°C 或更高) •发冷/颤抖 •困惑 •头晕或头昏眼花 •颤抖或抽搐(震颤) •心跳过快或心律不齐 •严重疲劳 •严重恶心、呕吐、腹泻 请务必告知您的医疗保健提供者您已接受 ABECMA 治疗,并向他们出示您的 ABECMA 患者钱包卡。您的医疗保健提供者可能会给您开其他药物来治疗您的副作用。 |
ABECMA 是什么? |
我将如何接受 ABECMA? |
接种 ABECMA 后我应该避免什么? •接受 ABECMA 治疗后至少八周内,请勿驾驶、操作重型机械或从事其他在精神不集中时可能造成危险的活动。这是因为治疗可能导致暂时的记忆和协调问题、嗜睡、思维混乱、头晕和癫痫发作。 •请勿捐献血液、器官、组织或细胞用于移植。 |
ABECMA 可能或很有可能出现哪些副作用? •疲劳 •发烧(100.4°F/38°C 或更高) •发冷/颤抖 •严重恶心或腹泻 •食欲下降 •头痛 •头晕 •困惑 •说话困难或口齿不清 •咳嗽 •呼吸困难 •心跳过快或心律不齐 在一项比较 ABECMA 与标准方案的研究中,与标准方案组相比,ABECMA 组随机分组后前 9 个月内死亡的患者比例更高。这种较高的早期死亡率主要出现在接受 ABECMA 治疗之前,主要原因是多发性骨髓瘤进展。接受 ABECMA 治疗后,因不良事件导致的死亡率也有所增加。 ABECMA 可引起一种非常常见的副作用,称为细胞因子释放综合征 (CRS),这种副作用可能很严重甚至致命。CRS 的症状包括发烧、呼吸困难、头晕或头昏眼花、恶心、头痛、心跳加快、低血压或疲劳。如果您在服用 ABECMA 后出现发烧或任何其他症状,请立即告知您的医疗保健提供者。 ABECMA 可能会增加危及生命的感染风险,甚至可能导致死亡。如果您出现发烧、发冷或任何感染迹象或症状,请立即告知您的医疗保健提供者。 ABECMA 可能会降低一种或多种血细胞(红细胞、白细胞或血小板)的水平,这可能会让您感到虚弱或疲倦,或增加严重感染或出血的风险。治疗后,您的医疗保健提供者将对您的血液进行检测。如果您发烧、感到疲倦或出现瘀伤或出血,请立即告知您的医疗保健提供者。 ABECMA 可能会增加您患癌症(包括某些类型的血癌)的风险。您的医疗保健提供者应对此进行监测。 血液中含有 ABECMA 可能会导致一些商业测试的人类免疫缺陷病毒 (HIV) 检测结果呈假阳性。 这些并不是 ABECMA 的所有可能副作用。请致电您的医生获取有关副作用的医疗建议。您可以拨打 1-800-FDA-1088 向 FDA 报告副作用。 |
有关 ABECMA 安全有效使用的一般信息 |
主要展示面板 - 30 毫升袋标签
idecabtagene vicleucel
Abecma™
NDC 59572-515-01
转基因自体 T 细胞
仅供自体和静脉使用
仅供静脉输液使用的悬浮液
每袋可接受容量 10mL - 30mL
剂量:参见处方信息和
输液证明书(托运人内)。
包含:300 至 510 x 10 6抗 BCMA02
CAR 阳性 T 细胞,保存在
含有 5% DMSO USP 的冷冻保存液中。
剂量可悬浮在 1 个或多个
输液袋中。
请勿使用白细胞去除过滤器
或进行辐照。
未评估传染性物质。
不含防腐剂。
储存在液氮气相中
(≤-130°C)。
制造商:Celgene Corporation,
百时美施贵宝公司
旗下子公司,美国新泽西州萨米特 07901
电话:1-888-805-4555
美国许可证号 2252
名:FIRST NAME
姓:LAST NAME
出生日期:DD-MMM-YYYY
DIN/Aph ID:W0000 00 000000
加入:XXXX-XXXXX
批次:XXXX-XXXXY
EXP:DD-MMM-YYYY
包袋编号:XX
日期: 2019-03-27
304492

主要展示面板 - 30 毫升盒式标签
idecabtagene vicleucel
Abecma™
NDC 59572-515-01
转基因自体 T 细胞
仅供自体和静脉使用
仅供静脉输液使用的悬浮液
每袋可接受容量 10mL - 30mL
剂量:参见处方信息和
输液证明书(托运人内)。
包含:300 至 510 x 10 6抗 BCMA02 CAR 阳性 T 细胞,
保存在含有 5% DMSO USP 的冷冻保存液中。
剂量可悬浮在 1 个或多个输液袋中。
请勿使用白细胞去除过滤器或进行辐照。
未评估传染性物质。不含防腐剂。
储存在液氮气相中(≤-130°C)。
制造商:Celgene Corporation,百时美施贵宝公司
旗下子公司,美国新泽西州萨米特 07901
电话:1-888-805-4555
美国许可证号 2252
名:FIRST NAME
姓:LAST NAME
出生日期:DD-MMM-YYYY
DIN/Aph ID:W0000 00 000000
加入:XXXX-XXXXX
批次:XXXX-XXXXY
EXP:DD-MMM-YYYY
包袋编号:XX
日期: 2019-03-27
304493

主要展示面板 - 70 毫升袋标签
idecabtagene vicleucel
Abecma™
NDC 59572-515-02
转基因自体 T 细胞
仅供自体和静脉使用
仅供静脉输液使用的悬浮液
每袋可接受容量 30mL - 70mL
剂量:参见处方信息和
输液证明书(托运人内)。
包含:300 至 510 x 10 6抗 BCMA02
CAR 阳性 T 细胞,保存在
含有 5% DMSO USP 的冷冻保存液中。
剂量可悬浮在 1 个或多个
输液袋中。
请勿使用白细胞去除过滤器
或进行辐照。
未评估传染性物质。
不含防腐剂。
储存在液氮气相中
(≤-130°C)。
制造商:Celgene Corporation,
百时美施贵宝公司
旗下子公司,美国新泽西州萨米特 07901
电话:1-888-805-4555
美国许可证号 2252
名:FIRST NAME
姓:LAST NAME
出生日期:DD-MMM-YYYY
DIN/Aph ID:W0000 00 000000
加入:XXXX-XXXXX
批次:XXXX-XXXXY
EXP:DD-MMM-YYYY
包袋编号:XX
日期: 2019-03-27
304492

主要展示面板 - 70 毫升盒式标签
idecabtagene vicleucel
Abecma™
NDC 59572-515-02
转基因自体 T 细胞
仅供自体和静脉使用
仅供静脉输液使用的悬浮液
每袋可接受容量 30mL - 70mL
剂量:参见处方信息和
输液证明书(托运人内)。
包含:300 至 510 x 10 6抗 BCMA02 CAR 阳性 T 细胞,
保存在含有 5% DMSO USP 的冷冻保存液中。
剂量可悬浮在 1 个或多个输液袋中。
请勿使用白细胞去除过滤器或进行辐照。
未评估传染性物质。不含防腐剂。
储存在液氮气相中(≤-130°C)。
制造商:Celgene Corporation,百时美施贵宝公司
旗下子公司,美国新泽西州萨米特 07901
电话:1-888-805-4555
美国许可证号 2252
名:FIRST NAME
姓:LAST NAME
出生日期:DD-MMM-YYYY
DIN/Aph ID:W0000 00 000000
加入:XXXX-XXXXX
批次:XXXX-XXXXY
EXP:DD-MMM-YYYY
包袋编号:XX
日期: 2019-03-27
304493

主要展示面板 - 100 毫升袋标签
idecabtagene vicleucel
Abecma™
NDC 59572-515-03
转基因自体 T 细胞
仅供自体和静脉使用
仅供静脉输液使用的悬浮液
每袋可接受容量 55 毫升 - 100 毫升
剂量:参见处方信息和
输液证明书(托运人内)。
包含:300 至 510 x 10 6抗 BCMA02
CAR 阳性 T 细胞,保存在
含有 5% DMSO USP 的冷冻保存液中。
剂量可悬浮在 1 个或多个
输液袋中。
请勿使用白细胞去除过滤器
或进行辐照。
未评估传染性物质。
不含防腐剂。
储存在液氮气相中
(≤-130°C)。
制造商:Celgene Corporation,
百时美施贵宝公司
旗下子公司,美国新泽西州萨米特 07901
电话:1-888-805-4555
美国许可证号 2252
名:FIRST NAME
姓:LAST NAME
出生日期:DD-MMM-YYYY
DIN/Aph ID:W0000 00 000000
加入:XXXX-XXXXX
批次:XXXX-XXXXY
EXP:DD-MMM-YYYY
包袋编号:XX
日期: 2019-03-27
304492

主要展示面板 - 100 毫升盒式标签
idecabtagene vicleucel
Abecma™
NDC 59572-515-03
转基因自体 T 细胞
仅供自体和静脉使用
仅供静脉输液使用的悬浮液
每袋可接受容量 55 毫升 - 100 毫升
剂量:参见处方信息和
输液证明书(托运人内)。
包含:300 至 510 x 10 6抗 BCMA02 CAR 阳性 T 细胞,
保存在含有 5% DMSO USP 的冷冻保存液中。
剂量可悬浮在 1 个或多个输液袋中。
请勿使用白细胞去除过滤器或进行辐照。
未评估传染性物质。不含防腐剂。
储存在液氮气相中(≤-130°C)。
制造商:Celgene Corporation,百时美施贵宝公司
旗下子公司,美国新泽西州萨米特 07901
电话:1-888-805-4555
美国许可证号 2252
名:FIRST NAME
姓:LAST NAME
出生日期:DD-MMM-YYYY
DIN/Aph ID:W0000 00 000000
加入:XXXX-XXXXX
批次:XXXX-XXXXY
EXP:DD-MMM-YYYY
包袋编号:XX
日期: 2019-03-27
304493

ABECMA |
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
贴标机 - Celgene Corporation (174201137) |
|||||||||||||||||||||||||